题目内容
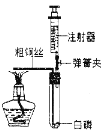
【题目】﹤1﹥根据如图所示的部分实验装置,回答有关问题
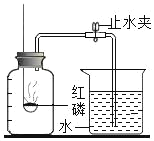
(1)写出图中仪器④的名称是_________。
(2)实验室常用装置A制O2,写出反应容器中产生O2 的化学方程式 _________ ;如用装置 D 进行收集,则应将导管 a 端与导管_____端相连。小明在帮老师整理实验室时,发现一瓶未密封的KOH固体,对其成分提出以下假设,并在老师的指导下进行实验探究。
(查阅资料):①KOH与NaOH的化学性质相似。请用化学方程式解释KOH变质的原因是____。
② K2CO3溶液呈碱性,BaCl2溶液、KCl溶液呈中性。
(猜想假设):假设I:只含KOH; 假设Ⅱ:含KOH和K2CO3; 假设Ⅲ:只含K2CO3
(进行实验):
实验操作步骤 | 实验现象 | 实验结论 |
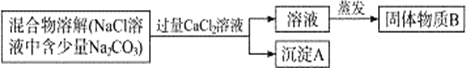
① 取少量样品于试管中,加入足量的稀盐酸 | 有气泡产生 | 假设_____不正确 |
② 另取少量样品于试管中,加水溶解,加入过量的BaCl2溶液,振荡,静置 | ____ | 假设Ⅲ正确 |
③ 取②中上层清液,滴加无色酚酞溶液 | _____ |
(问题讨论):步骤②中加入过量BaCl2溶液的作用是________。
(拓展应用):完全变质的KOH也有利用价值,从K2CO3的组成或性质看,这瓶变质的试剂在农业上的用途是_________。
【答案】集气瓶 2KClO3 ![]() 2KCl+3O2↑ c I 2KOH+CO2===K2CO3+H2O 产生白色沉淀 无色酚酞试液不变色 除尽碳酸钠,防止影响氢氧化钠的检验 作钾肥
2KCl+3O2↑ c I 2KOH+CO2===K2CO3+H2O 产生白色沉淀 无色酚酞试液不变色 除尽碳酸钠,防止影响氢氧化钠的检验 作钾肥
【解析】
(1)由所学知识可知,图中仪器④的名称是集气瓶;
(2) 实验室用氯酸钾法制取氧气常用装置A,反应容器中产生O2 的化学方程式 2KClO3 ![]() 2KCl+3O2↑ ;如用装置 D 进行收集,由于气体的密度比水的小,则应将导管 a 端与导管c端相连;
2KCl+3O2↑ ;如用装置 D 进行收集,由于气体的密度比水的小,则应将导管 a 端与导管c端相连;
[查阅资料]:①KOH与NaOH的化学性质相似。KOH变质的原因是氢氧化钾和二氧化碳反应生成碳酸钾和水,化学方程式为:2KOH+CO2===K2CO3+H2O;
[进行实验] ① 碳酸钾能与酸反应生成气体产生气泡,氢氧化钾不能,取少量样品于试管中,加入足量的稀盐酸 有气泡产生 假设I不正确;②假设Ⅲ正确,说明只有碳酸钾,氯化钡和碳酸钾反应生成碳酸钡沉淀,另取少量样品于试管中,加水溶解,加入过量的BaCl2溶液,振荡,静置,观察到有白色沉淀生成,③ 取②中上层清液,滴加无色酚酞溶液,无色酚酞试液不变色;
[问题讨论]:氢氧化钠和碳酸钠的溶液都呈碱性,都能使无色酚酞试液变红。步骤②中加入过量BaCl2溶液的作用是除尽碳酸钠,防止影响氢氧化钠的检验;
[拓展应用]:完全变质的KOH也有利用价值,从K2CO3的组成或性质看,这瓶变质的试剂在农业上的用途是钾肥。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
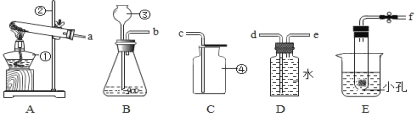
学练快车道口算心算速算天天练系列答案【题目】下图是实验室制取气体的常用装置。

(1)实验室用KMnO4制取O2应选用的一套实验装置为______(填字母代号);该反应的化学方程式为______。
(2)实验室制取CO2的发生装置______,选择气体发生装置时,应该考虑的因素有_____B的优点是_____,使B装置中反应停止的原理是_____。
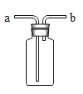
(3)若用下图装置采用排水法收集H2,请简述操作步骤。步骤:______。
(4)同学们从山上采集到一种石灰石,已知其主要成分是碳酸钙。为测定该石灰石样品中碳酸钙的质量分数,他们取10 g该样品与50g稀盐酸进行实验(杂质在过程中不参加反应),测得反应后烧杯中物质的总质量与反应时间的关系如下表:
反应时间/s | t0 | t1 | t2 | t3 | t4 | t5 |
反应后烧杯中物质的 总质量/g | 60 | 59 | 58.5 | 58 | 57.8 | 57.8 |
该石灰石样品中碳酸钙的质量分数是_____。