题目内容
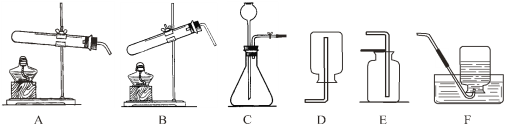
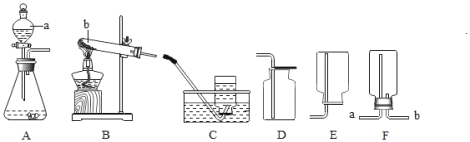
【题目】下图是实验室制取气体的常用装置。

(1)实验室用KMnO4制取O2应选用的一套实验装置为______(填字母代号);该反应的化学方程式为______。
(2)实验室制取CO2的发生装置______,选择气体发生装置时,应该考虑的因素有_____B的优点是_____,使B装置中反应停止的原理是_____。
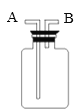
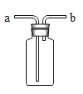
(3)若用下图装置采用排水法收集H2,请简述操作步骤。步骤:______。
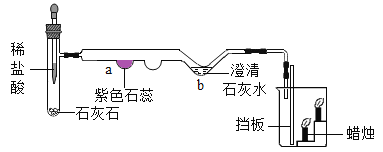
(4)同学们从山上采集到一种石灰石,已知其主要成分是碳酸钙。为测定该石灰石样品中碳酸钙的质量分数,他们取10 g该样品与50g稀盐酸进行实验(杂质在过程中不参加反应),测得反应后烧杯中物质的总质量与反应时间的关系如下表:
反应时间/s | t0 | t1 | t2 | t3 | t4 | t5 |
反应后烧杯中物质的 总质量/g | 60 | 59 | 58.5 | 58 | 57.8 | 57.8 |
该石灰石样品中碳酸钙的质量分数是_____。
【答案】AD或AE ![]() B或C 反应物状态、反应条件 控制反应的发生和停止 不用时关闭导气管的活塞,容器内继续反应产生的气体使容器内压强加大,使固液分离,反应即自行停止 首先,在洗气瓶里装满水,从b管内通入氢气,因为氢气难溶于水,所以氢气把水压入a管中排出,即排水法收集氢气 50%
B或C 反应物状态、反应条件 控制反应的发生和停止 不用时关闭导气管的活塞,容器内继续反应产生的气体使容器内压强加大,使固液分离,反应即自行停止 首先,在洗气瓶里装满水,从b管内通入氢气,因为氢气难溶于水,所以氢气把水压入a管中排出,即排水法收集氢气 50%
【解析】
(1)实验室用KMnO4制取O2的发生装置是固体加热型,氧气不易溶于水,可以用排水法或向上排空气法,该反应的化学方程式为![]() 。故填:AD或AE;
。故填:AD或AE;![]()
(2)实验室制取CO2为固液不加热,选择气体发生装置时,应该考虑的因素有反应物状态、反应条件,B的优点是控制反应的发生和停止,使B装置中反应停止的原理是不用时关闭导气管的活塞,容器内继续反应产生的气体使容器内压强加大,使固液分离,反应即自行停止。故填:B、C;反应物状态、反应条件;控制反应的发生和停止;不用时关闭导气管的活塞,容器内继续反应产生的气体使容器内压强加大,使固液分离,反应即自行停止。
(3)万用瓶的使用步骤为首先,在洗气瓶里装满水,从b管内通入氢气,因为氢气难溶于水,所以氢气把水压入a管中排出,即排水法收集氢气。故填:首先,在洗气瓶里装满水,从b管内通入氢气,因为氢气难溶于水,所以氢气把水压入a管中排出,即排水法收集氢气。
(4)解:反应前后质量差为气体的质量,则二氧化碳质量为60g-57.7g=2.2g
设碳酸钙的质量为x

![]()
x=5g
该石灰石样品中碳酸钙的质量分数=![]()
故填:50%

【题目】长时间使用的热水壶底部有一层水垢,主要成分是CaCO3和Mg(OH)2。学校化学研究性学习小组同学通过实验想测定水垢中CaCO3的含量为多少。他们取200g水垢,加入过量的稀盐酸,同时测量5分钟(min)内生成CO2质量,测量数据如下表:
时间/ min | 1 | 2 | 3 | 4 | 5 |
生成CO2的质量/g | 30 | 50 | 60 | 66 | 66 |
(1)4 min后,水垢中的CaCO3________ (是、否)反应完全。
(2)计算该水垢中CaCO3的质量分数?
【题目】﹤1﹥根据如图所示的部分实验装置,回答有关问题
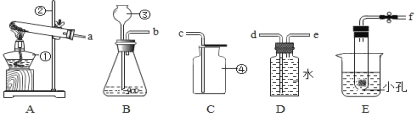
(1)写出图中仪器④的名称是_________。
(2)实验室常用装置A制O2,写出反应容器中产生O2 的化学方程式 _________ ;如用装置 D 进行收集,则应将导管 a 端与导管_____端相连。小明在帮老师整理实验室时,发现一瓶未密封的KOH固体,对其成分提出以下假设,并在老师的指导下进行实验探究。
(查阅资料):①KOH与NaOH的化学性质相似。请用化学方程式解释KOH变质的原因是____。
② K2CO3溶液呈碱性,BaCl2溶液、KCl溶液呈中性。
(猜想假设):假设I:只含KOH; 假设Ⅱ:含KOH和K2CO3; 假设Ⅲ:只含K2CO3
(进行实验):
实验操作步骤 | 实验现象 | 实验结论 |
① 取少量样品于试管中,加入足量的稀盐酸 | 有气泡产生 | 假设_____不正确 |
② 另取少量样品于试管中,加水溶解,加入过量的BaCl2溶液,振荡,静置 | ____ | 假设Ⅲ正确 |
③ 取②中上层清液,滴加无色酚酞溶液 | _____ |
(问题讨论):步骤②中加入过量BaCl2溶液的作用是________。
(拓展应用):完全变质的KOH也有利用价值,从K2CO3的组成或性质看,这瓶变质的试剂在农业上的用途是_________。