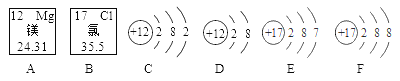
题目内容
【题目】某研究性课题小组对氢氧化钠溶液和稀盐酸中和反应的有关问题,进行了如下 探究:
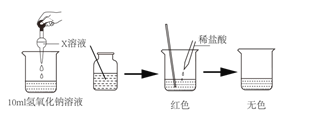
I:(1)甲同学为了证明氢氧化钠溶液与稀盐酸能够发生反应,设计并完成了如图 1 所示实 验,则 X 溶液是_____。
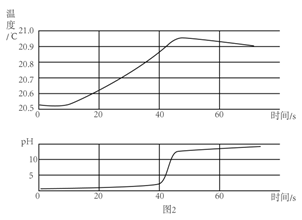
(2)乙同学用传感器探究稀 NaOH 溶液与稀盐酸反应过程中温度和 pH 的变化。测定结 果如图 2 所示。通过分析可知,稀 NaOH 溶液与稀盐酸反应会_____(填“放
出”或“吸收”)热量。30s 时,溶液中的溶质为_____(写化学式)。
II:丙同学为了验证上述实验,也将盐酸滴入某氢氧化钠溶液中,发现有气泡产生,他认为 该氢氧化钠溶液已经变质,变质原因用化学方程式可表示为_____。
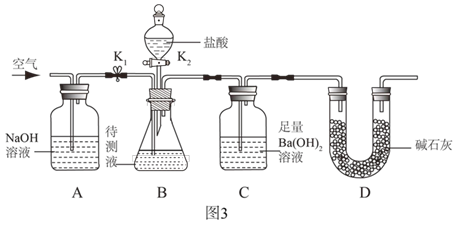
为了测定该氢氧化钠溶液中碳酸钠的质量分数,丙同学设计了如图 3 所示的实验装置。已知分液漏斗中装有 10%的稀盐酸,装置内试剂均足量。
(实验步骤)
①按如图 3 连接好装置后,并检查装置气密性;
②关闭 K1 和 K2,向 B 装置中加入 100.0g 该氢氧化钠溶液样品(忽略原装置内空气中二氧 化碳对实验的影响);
③打开 K2,向锥形瓶内滴加盐酸,直到 B 中不再产生气泡为止;
④打开 K1 关闭 K2,通入一段时间空气,至装置 C 中不再产生沉淀为止;
⑤将装置 C 中的固液混合物过滤、洗涤、烘干后称得固体质量为 5.0g。
(实验分析及数据处理)
①A 装置的作用是_____。
②若缺少步骤④,则测定结果将_____(填“偏大”、“偏小”或“不变”)。
③利用实验数据,计算该氢氧化钠溶液中碳酸钠的质量分数为 5.3%。
(实验反思)
①有同学提出,图 3 装置不变,可以分别称量装置 C 反应前后的质量,其差量为装置 B 中 反应生成的二氧化碳质量,经进一步计算可求得碳酸钠的质量分数,你是否同意该同学的意见?_____(填“同意”或“不同意”)请说明理由_____。
②下列各项措施中,能提高测定准确度的是_______________(填字母)
A.缓缓滴加稀盐酸
B.在装置 A、B 之间增加盛有浓硫酸的洗气瓶
C.在装置 B、C 之间增加盛有饱和 NaHCO3 的洗气瓶
【答案】 酚酞溶液 放出 NaOH和HCl 2NaOH+CO2 ==Na2CO3+H2O 除去空气中的二氧化碳 偏小 ①不同意 Ba(OH)2溶液吸收盐酸中挥发出的HCl气体或气流带走Ba(OH)2
溶液中的水蒸气,都会导致 Ba(OH)2 增重测定不准确 A
【解析】本题考查了中和反应和测定物质的组成。根据实验目的和实验原理进行分析。
I 、(1) 氢氧化钠溶液遇酚酞溶液呈红色,氢氧化钠与盐酸反应后,氢氧化钠消失,碱性消失。在氢氧化钠溶液中滴加酚酞溶液,溶液呈红色,滴加盐酸后红色褪去,证明了氢氧化钠溶液与稀盐酸能够发生反应。所以X是酚酞溶液;
(2)根据图2可知,反应过程中溶液的温度升高,稀NaOH溶液与稀盐酸反应会放出热量。30s 时,溶液的pH<7,反应还没有完全,溶液中存在未反应的盐酸和生成氯化钠,化学式分别为:NaOH和HCl;
II、氢氧化钠变质原因是氢氧化钠与二氧化碳反应生成碳酸钠和水,化学方程式是:2NaOH+CO2 ==Na2CO3+H2O;
实验分析及数据处理:
①A 装置中盛放的是氢氧化钠溶液,除去空气中的二氧化碳;
②如果缺少步骤④,空气在反应结束以后立即停止,会使得生成的气体无法全部进入吸收装置中,测得的 CO2的质量偏小,造成碳酸钠的质量偏小。
实验反思:①不同意;Ba(OH)2 溶液吸收盐酸中挥发出的HCl气体或气流带走Ba(OH)2溶液中的水蒸气,都会导致 Ba(OH)2 增重测定不准确;
②本题的原理在于测量二氧化碳的质量从而计算碳酸钠的质量,因此提高准确度就是要使得二氧化碳的质量更加精准:A、缓缓滴加稀盐酸,可以避免反应太快,导致生成二氧化碳气流流速过快,引起二氧化碳不充分吸收,可以提高准确度,正确;B、在装置 A、B 间增加浓硫酸,可以除去水蒸气,但对于本题测定二氧化碳的含量无影响,不可以提高准确度,错误;C、挥发出来的HCl进入盛有 NaHCO3溶液的洗气瓶,NaHCO3+HCl=NaCl+H2O+CO2↑,使得生成的二氧化碳偏多,造成误差,不可以提高准确度,错误。故选A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在浓硫酸的作用下,固体草酸(H2C2O4)受热分解生成碳的氧化物和水。某化学课外兴趣小组对碳的氧化物的成分进行了实验探究。
(提出问题)如何通过实验确定碳的氧化物的成分。
(猜 想)
猜想1 | 猜想2 | 猜想3 |
只有CO | 只有_____________ | CO和CO2都有 |
(设计实验)基于猜想3,兴趣小组同学设计了如下实验装置:
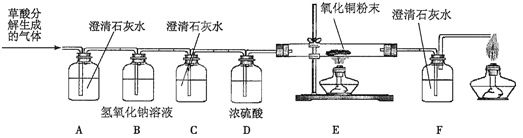
(实验探究)
(1)实验过程中观察到_________装置(填字母)中的澄清石灰水变浑浊,证明有CO2气体;
(2)实验过程中还观察到以下实验现象:①C装置中澄清石灰水不变浑浊;②E装置中黑色粉末变成红色;③___________________,证明有CO气体;
(实验结论)通过实验探究证明:猜想3成立
草酸分解的化学方程式是_____________________________________;
(问题讨论)
C装置的作用是_______________________;D装置的作用是_______________________。
【题目】下列表中的叙述、对应的化学方程式和所属基本反应类型都正确的是( )
叙述 | 化学反应方程式 | 反应类型 | |
A | 拉瓦锡研究空气成分 | 2HgO | 分解反应 |
B | 探究一氧化碳的还原性 | CO+CuO | 置换反应 |
C | 用二氧化碳制作碳酸饮料 | CO2+H2O═H2CO3 | 化和反应 |
D | 用稀硫酸除铁锈 | Fe2O3+3H2SO4═Fe2(SO4)3+3H2O | 复分解反应 |
A. A B. B C. C D. D
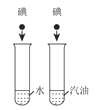
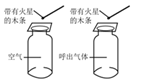
【题目】下列实验中,对应的现象以及结论都正确且两者相符的是( )
选 项 | A | B | C | D |
实 验 |
|
|
|
|
实 验 现 象 | 打开汽水瓶盖时,汽水 会自动喷出来 | 碘溶于水,几乎不溶于 汽油 | 白磷燃烧,产生大量白 烟,活塞先向右再向左移动,冷却至室温后, 最终停在刻度“4”附近 | 空气中,带火星的木条 复燃;呼出气体中,带 火星的木条熄灭 |
实 验 结 论 | 说明气体在水中的溶 解度随压强的增大而 减小 | 说明物质的溶解性与 溶剂的种类有关 | 氧气约占空气体积的 五分之一 | 空气中的氧气比呼出 气体中氧气多 |
A. A B. B C. C D. D
【题目】在实验室中,化学兴趣小组的同学发现了一瓶敞口放置的Ca(OH)2粉末状试剂,他们对该试剂进行了定量实验分析:称取试剂19.8g放入锥形瓶中,加入30.2g的水,充分振荡,再向锥形瓶中依次滴加25g盐酸成分反应,测得部分数据与图象如下,请根据有关信息回答问题。
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | 第6次 | |
加入盐酸的质量(g) | 25 | 25 | 25 | 25 | 25 | 25 |
锥形瓶中物质的质量(g) | 75 | 100 | a | 150 | 172.8 | 197.8 |
(1)a的数值为____________;
(2)b的数值为____________;
(3)计算该试剂中氢氧化钙的质量分数(计算结果保留一位小数)______________。