题目内容
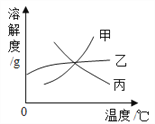
【题目】甲、乙两种不含结晶水的固体物质的溶解度曲线如图所示,下列说法中不正确的是
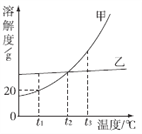
A. t1 ℃时,60 g甲的饱和溶液中溶解了10 g的甲
B. 将t2 ℃甲、乙两种物质的饱和溶液升温至t3 ℃(溶剂的量不变),两种溶液中溶质的质量分数相等
C. t2 ℃时,要使接近饱和的乙溶液达到饱和状态,可蒸发溶剂
D. t2 ℃甲、乙两种物质的饱和溶液中所含溶质的质量相等
【答案】D
【解析】A、t1℃时甲物质的溶解度为20g,即100g水中溶解20g甲物质形成120g饱和溶液,所以t1℃时,60g甲的饱和溶液中溶解了10g的甲,正确;B、t2℃甲、乙两种物质的溶解度相同,所以t2℃甲、乙两种物质的溶液的饱和溶液的溶质质量分数相同,甲、乙物质的溶解度随温度的升高而增大,所以升温至t3℃(溶剂的量不变),没有溶质析出,两种溶液中溶质的质量分数相等,正确;C、乙物质的溶解度受温度的影响变化不大,所以t2℃时,要使接近饱和的乙溶液达到饱和状态,可采用蒸发溶剂的方法,正确;D、t2℃时,甲、乙两种饱和溶液的质量不能确定,所以溶液中的溶质质量也不能确定,错误。故选D。

练习册系列答案
相关题目