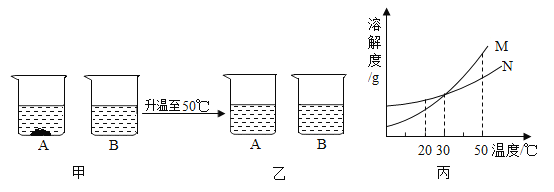
题目内容
【题目】化学兴趣小组的同学们探究用Fe从含Fe2(SO4)3和CuSO4的溶液中获取金属Cu的原理,请你一起参与探究。小明将光亮的铁丝插入含Fe2(SO4)3和CuSO4的废液中,一段时间后取出,意外地发现铁丝表面没有变红。
(提出问题)Fe为什么没有从废液中置换出Cu呢?
(查阅资料)硫酸铁溶液为黄色,其中的三价铁离子具有较强的氧化性,所以能和很多金属反应,如能和铁或铜发生反应。
(进行猜想)小丽认为在铁丝表面可能有Cu析出,但被Fe2(SO4)3溶液溶解了。
(实验探究)小宇对小丽的猜想以及信息都有怀疑,于是,他们共同做了以下实验:
主要实验用品:洁净的铁丝和铜丝各两根,相同体积、相同浓度的Fe2(SO4)3溶液三份。
实验操作 | 实验现象和数据 | 结论 |
①准确称量洁净的铁丝和铜丝的质量 | 铁丝质量为ag, 铜丝质量为bg | |
②将铁丝插入Fe2(SO4)3溶液中,一段时间后取出、洗净、干燥、称量 | 铁丝质量为mg, m<a,溶液由黄色变为浅绿色 | 一定有__生成(填化学式) |
③将铜丝插入Fe2(SO4)3溶液中,一段时间后取出、洗净、干燥、称量 | 铜丝质量为ng n____b(填>或<) | 铜确实能与Fe2(SO4)3溶液反应 |
④另取相同质量、相同粗细的洁净铁丝和铜丝互相缠绕,插入Fe2(SO4)3溶液中,一段时间后取出、洗净、干燥、分别称量铁丝和铜丝的质量 | 铁丝质量减轻 铜丝质量不变 | Fe、Cu共存时____优先与Fe2(SO4)3溶液反应 |
(探究结论)小丽的假设______(选填“成立”或“不成立”),理由是____。
(拓展分析)①兴趣小组的同学们通过对上述实验的分析,找到了用Fe从含Fe2(SO4)3和CuSO4的溶液中提取金属Cu的关键,并且最终实验获得了成功,其实验成功的关键是:__________,并且反应充分。②已知Fe和Fe2(SO4)3发生化合反应,请按反应顺序写出用Fe从含Fe2(SO4)3和CuSO4的溶液中获取金属Cu的化学方程式:_______;_______。
【答案】硫酸亚铁(或FeSO4) < 铁(或Fe) 不成立 Fe、Cu共存时Fe优先与Fe2(SO4)3溶液反应 加入过量的铁 Fe+Fe2(SO4)3=3FeSO4 Fe+CuSO4=FeSO4+Cu
【解析】
实验探究:
②根据反应后铁丝的质量减少了,并且溶液由黄色变为浅绿色,确定为硫酸亚铁溶液。
③将铜丝插入硫酸铁溶液中,一段时间后取出、洗净、干燥、称量,铜丝质量为ng(n<b),铜能与硫酸铁溶液反应。
④根据实验后的现象“铁丝质量较轻,铜丝质量不变”得知Fe、Cu共存时Fe优先与硫酸铁溶液反应。
探究结论:
用Fe从含硫酸铁和硫酸铜的溶液中获取金属Cu,实验过程Fe没有从废液中置换出Cu,小丽认为在铁丝表面可能有Cu析出,但被硫酸铁溶液溶解了,但是根据实验探究的结果发现Fe、Cu共存时Fe优先与硫酸铁溶液反应,所以小丽的假设错误的,故答案为:不成立;Fe、Cu共存时Fe优先与硫酸铁溶液反应。
拓展
①根据实验探究的结果,我们得知铁先于硫酸铁溶液反应生成硫酸亚铁,所以只有加入过量的铁才能发生铁与硫酸铜溶液的置换反应,从而生成铜,故答案为:加入过量的铁。
②已知Fe和硫酸铁发生化合反应,且生成的是浅绿色的溶液;铁与硫酸铜溶液的反应属于置换反应,故答案为:![]() ;
;![]() 。
。