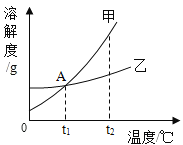
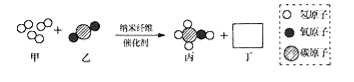
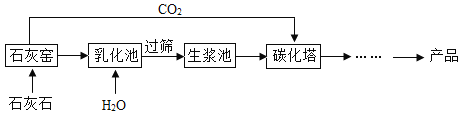
题目内容
【题目】镁是航空工业的重要材料,镁合金用于制造飞机机身、发动机零件等;镁还用来制造照相和光学仪器等;已知镁的原子序数是12,下列说法不正确的是 ( )
A.2Mg表示2个镁原子
B.Mg的原子结构示意图是: 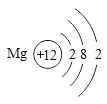
C.Mg在元素周期表中的位置是:第三行第二列
D.Mg在化学反应中易得到2个电子,变为正二价的镁离子
【答案】D
【解析】
A、2Mg表示2个镁原子,该选项说法正确,不符合题意;
B、Mg的原子结构示意图是: ,该选项说法正确,不符合题意;
,该选项说法正确,不符合题意;
C、Mg元素核外电子层数是3,处在第三周期,最外层电子数是2,处在第二列,该选项说法正确,不符合题意;
D、Mg在化学反应中易失去2个电子,变为正二价的镁离子,该选项说法不正确,符合题意。
故选:D。

【题目】化学兴趣小组的同学们探究用Fe从含Fe2(SO4)3和CuSO4的溶液中获取金属Cu的原理,请你一起参与探究。小明将光亮的铁丝插入含Fe2(SO4)3和CuSO4的废液中,一段时间后取出,意外地发现铁丝表面没有变红。
(提出问题)Fe为什么没有从废液中置换出Cu呢?
(查阅资料)硫酸铁溶液为黄色,其中的三价铁离子具有较强的氧化性,所以能和很多金属反应,如能和铁或铜发生反应。
(进行猜想)小丽认为在铁丝表面可能有Cu析出,但被Fe2(SO4)3溶液溶解了。
(实验探究)小宇对小丽的猜想以及信息都有怀疑,于是,他们共同做了以下实验:
主要实验用品:洁净的铁丝和铜丝各两根,相同体积、相同浓度的Fe2(SO4)3溶液三份。
实验操作 | 实验现象和数据 | 结论 |
①准确称量洁净的铁丝和铜丝的质量 | 铁丝质量为ag, 铜丝质量为bg | |
②将铁丝插入Fe2(SO4)3溶液中,一段时间后取出、洗净、干燥、称量 | 铁丝质量为mg, m<a,溶液由黄色变为浅绿色 | 一定有__生成(填化学式) |
③将铜丝插入Fe2(SO4)3溶液中,一段时间后取出、洗净、干燥、称量 | 铜丝质量为ng n____b(填>或<) | 铜确实能与Fe2(SO4)3溶液反应 |
④另取相同质量、相同粗细的洁净铁丝和铜丝互相缠绕,插入Fe2(SO4)3溶液中,一段时间后取出、洗净、干燥、分别称量铁丝和铜丝的质量 | 铁丝质量减轻 铜丝质量不变 | Fe、Cu共存时____优先与Fe2(SO4)3溶液反应 |
(探究结论)小丽的假设______(选填“成立”或“不成立”),理由是____。
(拓展分析)①兴趣小组的同学们通过对上述实验的分析,找到了用Fe从含Fe2(SO4)3和CuSO4的溶液中提取金属Cu的关键,并且最终实验获得了成功,其实验成功的关键是:__________,并且反应充分。②已知Fe和Fe2(SO4)3发生化合反应,请按反应顺序写出用Fe从含Fe2(SO4)3和CuSO4的溶液中获取金属Cu的化学方程式:_______;_______。