题目内容
【题目】(一)铁材料的有关知识
(1)人类使用金属先后经历了“青铜”、“铁器”时代,到近代才开始大量使用铝材料.这也反映出Cu、Fe、Al三种金属的活动性由强到弱的顺序是_____.
(2)在西汉时期就有“曾青得铁则化为铜”之说,用化学方程式表示其原理_____.
(3)钢铁露置在空气中易生锈,写出一种防止钢铁生锈的方法_____.
以下是同学对铁锈的成分、铁锈制草酸亚铁晶体及草酸亚铁晶体热分解的研究.
(二)用上述铁锈制草酸亚铁晶体(FeC2O4·nH2O)
资料:①FeSO4遇到氧气氧化,会转化为Fe2(SO4)3.
②FeSO4的溶解度如下表:
温度/℃ | 0 | 10 | 30 | 50 | 60 | 70 | 80 | 90 |
溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.3 | 33.0 | 30.5 | 27.0 |
(制备流程)
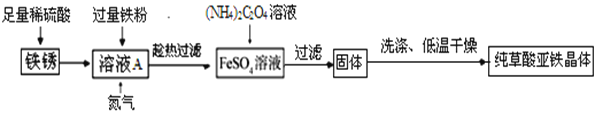
(1)溶液加入过量铁粉,发生的反应有:Fe+Fe2(SO4)3=3FeSO4、_____.充分反应后要趁热过滤的目的是_____.
(2)流程中产生草酸亚铁晶体反应的化学方程式为_____.
(3)制备过程中,溶液中通入氮气的作用是_____.
(三)探究FeC2O4·nH2O热分解的产物及n的值
(实验装置)
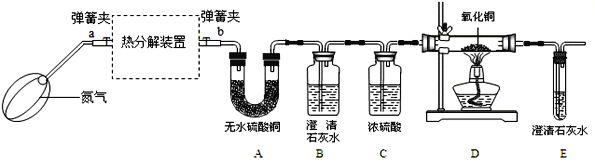
资料:①FeC2O4·nH2O为淡黄色粉末;FeO和Fe3O4都是黑色固体,其中FeO易被氧气氧化.
②FeC2O4·nH2O加热至300℃完全失去结晶水;继续加热至400℃,剩余固体受热分解产生黑色固体、CO2和CO.
(实验分析)
(1)若通过E装置中澄清石灰水变浑浊来证明草酸亚铁晶体热分解产生CO,则需在B和C装置之间增加盛有_____(填试剂名称)的洗气瓶.
(2)先鼓入氮气,再加热分解装置的原因是_____.
(3)指出上述实验装置不足之处_____.
(4)取3.60gFeC2O4·nH2O,按上述实验步骤进行实验,测得热分解装置中固体量随温度变化曲线如下图所示:
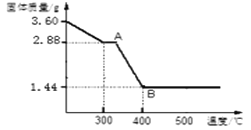
①FeC2O4·nH2O中n的值为_____.
②反应后,热分解装置中残留的黑色物质为_____(填化学式).
③草酸亚铁晶体受热分解的方程式为_____.
④若将图中1.44g固体在空气中充分加热,固体增加0.16g,此固体(铁的氧化物)为_____。
【答案】Al>Fe>Cu Fe+CuSO4====Cu+FeSO4 刷漆、涂油等 Fe+H2SO4=FeSO4+H2↑ 防止FeSO4因结晶而造成损失 (NH4)2C2O4+FeSO4=FeC2O4↓+(NH4)2SO4
或nH2O+(NH4)2C2O4+FeSO4=FeC2O4.·nH2O↓+(NH4)2SO4 防止FeSO4氧化成Fe2(SO4)3 氢氧化钠溶液 排出装置内原有气体,防止产生干扰(合理答案均可) 没有进行尾气处理 2 FeO FeC2O42H2O![]() FeO+CO↑+CO2↑+2H2O Fe2O3
FeO+CO↑+CO2↑+2H2O Fe2O3
【解析】
(一)(1)人类使用金属越早,说明该金属越不活泼,因此三种金属的活动性由强到弱的顺序是Al>Fe>Cu;
(2)在西汉时期就有“曾青得铁则化为铜”之说,其原理是铁和硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式为:Fe+CuSO4═Cu+FeSO4;
(3)钢铁露置在空气中易生锈,刷漆、涂油等可以防止钢铁生锈;
(二)(1)溶液加入过量铁粉,铁和硫酸铁反应生成硫酸亚铁,和硫酸反应生成硫酸亚铁和氢气,反应的化学方程式为:Fe+Fe2(SO4)3=3FeSO4、Fe+H2SO4═FeSO4+H2↑;充分反应后要趁热过滤的目的是:防止FeSO4因结晶而造成损失;
(2)流程中产生草酸亚铁晶体反应的化学方程式为:(NH4)2C2O4+FeSO4=FeC2O4↓+(NH4)2SO4或(NH4)2C2O4+FeSO4+nH2O=FeC2O4nH2O↓+(NH4)2SO4;
(3)制备过程中,溶液中通入氮气的作用是防止FeSO4氧化成Fe2(SO4)3;
(三)(1)若通过E装置中澄清石灰水变浑浊来证明草酸亚铁晶体热分解的气体CO,则需在C和D装置之间增加盛有氢氧化钠溶液的洗气瓶,以吸收二氧化碳气体;
(2)先鼓入氮气,再加热分解装置的原因是:排出装置内原有气体,防止产生干扰;
(3)上述实验装置不足之处是:没有进行尾气处理,会导致一氧化碳扩散到空气中污染环境;
(4)①结晶水质量为:3.60g﹣2.88g=0.72g
根据题意有144:18n=2.88g:0.72g
n=2
②3.60g晶体中铁元素质量为:3.60g×![]() =1.12g
=1.12g
反应后,热分解装置中残留的黑色物质中铁原子和氧原子个数比为![]() :
:![]() =1:1,即热分解装置中残留的黑色物质是氧化亚铁,化学式为:FeO;
=1:1,即热分解装置中残留的黑色物质是氧化亚铁,化学式为:FeO;
③草酸亚铁晶体受热分解生成氧化亚铁、二氧化碳、一氧化碳和水,反应的化学方程式为:FeC2O42H2O![]() FeO+CO↑+CO2↑+2H2O;
FeO+CO↑+CO2↑+2H2O;
④若将图中1.44g固体在空气中充分加热,固体增加0.16g,说明参加反应的氧气质量为0.16g,
此固体(铁的氧化物)中铁原子和氧原子个数比为![]() :
:![]() =2:3,即铁的氧化物是三氧化二铁。
=2:3,即铁的氧化物是三氧化二铁。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案【题目】下列四环相交处是甲、乙、丙、丁四种物质相互混合后出现的现象.下表中符合四环关系的是( )
甲 | 乙 | 丙 | 丁 |
| |
A | K2CO3 | HCl | Ca(OH)2 | CuSO4 | |
B | K2CO3 | H2SO4 | Ba(OH)2 | 石蕊 | |
C | K2SO4 | HCl | Ba(OH)2 | 石蕊 | |
D | HCl | K2CO3 | Ca(OH)2 | 酚酞 |
A. AB. BC. CD. D