题目内容
【题目】如图为某化学反应的微观模拟示意图,下列说法中不正确的是( )

A. 该反应不属于分解反应
B. 图示中X的数值为3
C. 反应前后氢元素的化合价发生了改变
D. 反应中甲、丙两物质的质量比为2:7
【答案】D
【解析】
由变化过程的微粒结构以及变化过程可知该反应的方程式为:CH4+H2O![]() CO+3H2。
CO+3H2。
A、分解反应的特征是“一变多”,该反应的反应物不是一种,不属于分解反应,选项正确;
B、根据化学反应前后原子的种类和个数都不变,可知产生氢气分子的个数是3,因此x=3,选项正确;
C、有单质参加或有单质生成的反应一定有元素的化合价的变化,分析元素的化合价的变化,反应前化合物中的氢元素变成了单质中的氢元素,化合价由+1价变成0价,选项正确;
D、反应中甲烷分子和一氧化碳分子的个数比是1:1,因此质量比为:16:28=4:7,选项错误,故选D

【题目】(一)铁材料的有关知识
(1)人类使用金属先后经历了“青铜”、“铁器”时代,到近代才开始大量使用铝材料.这也反映出Cu、Fe、Al三种金属的活动性由强到弱的顺序是_____.
(2)在西汉时期就有“曾青得铁则化为铜”之说,用化学方程式表示其原理_____.
(3)钢铁露置在空气中易生锈,写出一种防止钢铁生锈的方法_____.
以下是同学对铁锈的成分、铁锈制草酸亚铁晶体及草酸亚铁晶体热分解的研究.
(二)用上述铁锈制草酸亚铁晶体(FeC2O4·nH2O)
资料:①FeSO4遇到氧气氧化,会转化为Fe2(SO4)3.
②FeSO4的溶解度如下表:
温度/℃ | 0 | 10 | 30 | 50 | 60 | 70 | 80 | 90 |
溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.3 | 33.0 | 30.5 | 27.0 |
(制备流程)
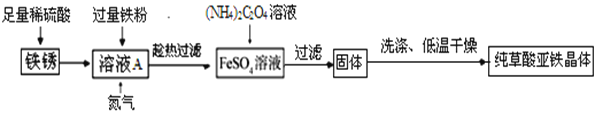
(1)溶液加入过量铁粉,发生的反应有:Fe+Fe2(SO4)3=3FeSO4、_____.充分反应后要趁热过滤的目的是_____.
(2)流程中产生草酸亚铁晶体反应的化学方程式为_____.
(3)制备过程中,溶液中通入氮气的作用是_____.
(三)探究FeC2O4·nH2O热分解的产物及n的值
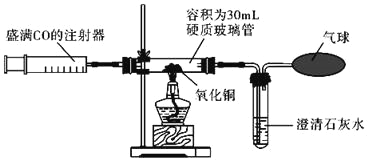
(实验装置)
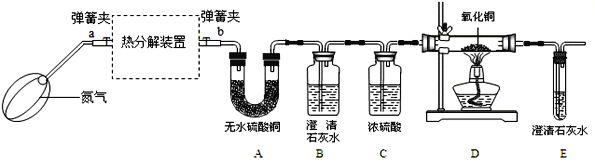
资料:①FeC2O4·nH2O为淡黄色粉末;FeO和Fe3O4都是黑色固体,其中FeO易被氧气氧化.
②FeC2O4·nH2O加热至300℃完全失去结晶水;继续加热至400℃,剩余固体受热分解产生黑色固体、CO2和CO.
(实验分析)
(1)若通过E装置中澄清石灰水变浑浊来证明草酸亚铁晶体热分解产生CO,则需在B和C装置之间增加盛有_____(填试剂名称)的洗气瓶.
(2)先鼓入氮气,再加热分解装置的原因是_____.
(3)指出上述实验装置不足之处_____.
(4)取3.60gFeC2O4·nH2O,按上述实验步骤进行实验,测得热分解装置中固体量随温度变化曲线如下图所示:
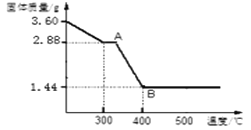
①FeC2O4·nH2O中n的值为_____.
②反应后,热分解装置中残留的黑色物质为_____(填化学式).
③草酸亚铁晶体受热分解的方程式为_____.
④若将图中1.44g固体在空气中充分加热,固体增加0.16g,此固体(铁的氧化物)为_____。