题目内容
【题目】相关实验原理与化学反应方程式的书写都正确的是( )
A. 铁丝在氧气中燃烧:4Fe+3O2![]() 2Fe2O3
2Fe2O3
B. 洗去试管壁上附着的铜:Cu+H2SO4=CuSO4+H2↑
C. 用氢氧化钠吸收二氧化硫:2NaOH+SO2=Na2SO4+H2O
D. 工业制取二氧化碳:CaCO3![]() CaO+CO2↑
CaO+CO2↑
【答案】D
【解析】
A、铁在氧气中燃烧生成四氧化三铁,正确的化学方程式为3Fe+2O2![]() Fe3O4。选项错误;
Fe3O4。选项错误;
B、铜的金属活动性比氢弱,不能与硫酸发生置换反应,选项错误;
C、氢氧化钠溶液与二氧化硫反应生成亚硫酸钠和水,正确的化学方程式为2NaOH+SO2═Na2SO3+H2O,选项错误;
D、工业制取二氧化碳是利用碳酸钙在高温的条件下分解,生成氧化钙和二氧化碳,该化学方程式书写完全正确。故选D。

【题目】NH4Cl和Na2SO4的溶解度表及溶解度曲线如下。下列说法正确的是( )
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度S/g | NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 60.2 |
Na2SO4 | 9.6 | 20.2 | 40.8 | 48.4 | 47.5 | 47.0 | |

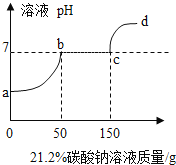
A. t3应介于40℃~50℃
B. 将t3℃时Na2SO4的饱和溶液降温至t1℃,c点将沿曲线c→b→a运动
C. 甲、乙饱和溶液从t2升温到t3,溶质的质量分数都不变
D. 将d点甲、乙溶液移至c点,可采用的方法只有加入溶质甲、乙,且溶质质量分数增大
【题目】(一)铁材料的有关知识
(1)人类使用金属先后经历了“青铜”、“铁器”时代,到近代才开始大量使用铝材料.这也反映出Cu、Fe、Al三种金属的活动性由强到弱的顺序是_____.
(2)在西汉时期就有“曾青得铁则化为铜”之说,用化学方程式表示其原理_____.
(3)钢铁露置在空气中易生锈,写出一种防止钢铁生锈的方法_____.
以下是同学对铁锈的成分、铁锈制草酸亚铁晶体及草酸亚铁晶体热分解的研究.
(二)用上述铁锈制草酸亚铁晶体(FeC2O4·nH2O)
资料:①FeSO4遇到氧气氧化,会转化为Fe2(SO4)3.
②FeSO4的溶解度如下表:
温度/℃ | 0 | 10 | 30 | 50 | 60 | 70 | 80 | 90 |
溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.3 | 33.0 | 30.5 | 27.0 |
(制备流程)
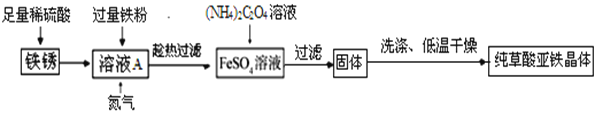
(1)溶液加入过量铁粉,发生的反应有:Fe+Fe2(SO4)3=3FeSO4、_____.充分反应后要趁热过滤的目的是_____.
(2)流程中产生草酸亚铁晶体反应的化学方程式为_____.
(3)制备过程中,溶液中通入氮气的作用是_____.
(三)探究FeC2O4·nH2O热分解的产物及n的值
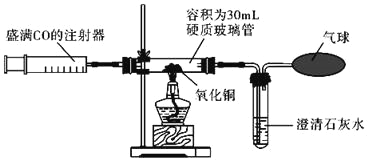
(实验装置)
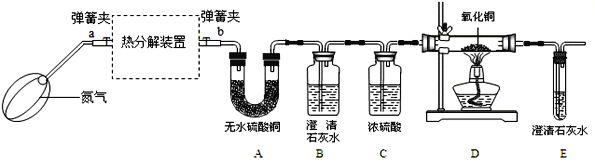
资料:①FeC2O4·nH2O为淡黄色粉末;FeO和Fe3O4都是黑色固体,其中FeO易被氧气氧化.
②FeC2O4·nH2O加热至300℃完全失去结晶水;继续加热至400℃,剩余固体受热分解产生黑色固体、CO2和CO.
(实验分析)
(1)若通过E装置中澄清石灰水变浑浊来证明草酸亚铁晶体热分解产生CO,则需在B和C装置之间增加盛有_____(填试剂名称)的洗气瓶.
(2)先鼓入氮气,再加热分解装置的原因是_____.
(3)指出上述实验装置不足之处_____.
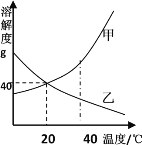
(4)取3.60gFeC2O4·nH2O,按上述实验步骤进行实验,测得热分解装置中固体量随温度变化曲线如下图所示:
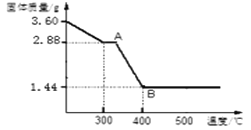
①FeC2O4·nH2O中n的值为_____.
②反应后,热分解装置中残留的黑色物质为_____(填化学式).
③草酸亚铁晶体受热分解的方程式为_____.
④若将图中1.44g固体在空气中充分加热,固体增加0.16g,此固体(铁的氧化物)为_____。