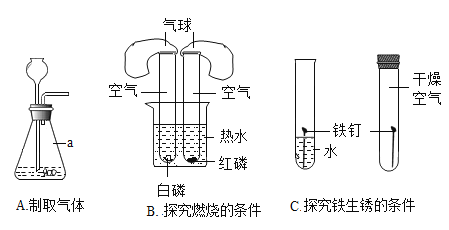
��Ŀ����
����Ŀ��CaO��NaOH����Ļ�����������ʯ������ʵ���ҳ��������������ʯ���ڿ������û����տ����е�ˮ�Ͷ�����̼�����ʣ�ijʵ��С��Ϊȷ��һƿ���õļ�ʯ����Ʒ�ijɷ֣������ͼ��ʾʵ�����̣�
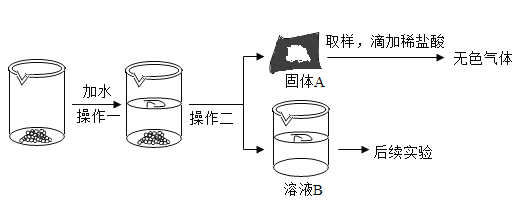
�������̽�����̣�
��1��Ϊ��ʹ��Ʒ����ܽ⣬����һ�л�Ҫ�õ��IJ���������__����������������__��
��2������A��һ������__��
��3����ҺB�ɷֵ�̽����
���������ϣ�
��Ca(OH)2��Na2CO3����ˮ�����Ե��¶ȱ仯��
��Na2CO3��Һ�ʼ��ԣ���ʹ��̪��Һ��죻
��CaCl2��Һ������������̼���Ʒ������ֽⷴӦ��
�����룩��ҺB�����ʿ���Ϊ����NaOH ��Na2CO3��NaOH��Na2CO3��Ca(OH)2��__
����Ʒ���������ʵ�飩�ס���ͬѧ�ֱ�������·���������̽����
��ͬѧ��ȡ������ҺB���Թ��У��μ�������ϡ���ᣬ�����������ݣ�����ҺB�е�������Na2CO3��
��ͬѧ��ȡ������ҺB���Թ��У��μӼ��η�̪��Һ����Һ��ɺ�ɫ������ҺB�е�����һ������NaOH����ͬѧ�������������λͬѧ��ʵ�飬��Ϊ���ǵĽ��۾��в���֮����������������ȷ���жϣ�����ΪB��Һ��һ������Na2CO3�����ܺ���NaOH��Ϊ��һ��ȷ����ҺB���Ƿ�NaOH������������ʵ�飮
ʵ�鲽�� | ʵ������ | ʵ����� |
��ȡ������ҺB���Թ��У���������CaCl2��Һ�� �ڹ��ˣ�����Һ�еμӷ�̪��Һ | __ | �������ȷ |
ʵ�鲽��ٵ�Ŀ����__��
��4��ʵ������У�ͬѧ�Ƿ�������Ʒ�м�ˮʱ���ų��������ȣ��ۺ�����̽�������ж���Ʒ�ɷַ�����ȷ����__������ţ���
A һ����
B һ����Na2CO3
C һ����CaO
D ������NaOH��CaO�е�һ�֣�
���𰸡������� ���� ̼��� NaOH �а�ɫ������������ɫ��̪��Һ��� ʹ̼������ȫ��Ӧ��������������Ƶļ���������� D
��������
��1��Ϊ��ʹ��Ʒ����ܽ⣬����һ�л�Ҫ�õ��IJ��������Dz����������������裬�����ܽ����ʵ����ã������������
�������������ǹ��ˣ�������Һ�Ͳ�����ˮ�����ʷ��룬������ˣ�
��2������A��ϡ���ᷴӦ�������壬˵������̼��ƣ�̼��ƺ�ϡ���ᷴӦ�����˶�����̼���壬���̼��ƣ�
��3�����룺��������������е�ˮ��Ӧ�����������ƣ�����������������еĶ�����̼��Ӧ����̼��ƺ�ˮ������������������еĶ�����̼��Ӧ����̼���ƺ�ˮ��̼�����ܺ��������Ʒ�Ӧ����̼��ƺ��������ƣ�̼��Ʋ�����ˮ������ҺB�����ʿ���Ϊ����NaOH ��Na2CO3��NaOH��Na2CO3��Ca(OH)2��NaOH�����NaOH��
ʵ�����Ϊ���������ȷ������ҺB������ΪNaOH��Na2CO3���ʢ�ȡ������ҺB���Թ��У���������CaCl2��Һ���Ȼ�������̼���Ʒ�Ӧ����̼��ƺ��Ȼ��ƣ����ˣ���ȥ̼��ƣ�����Һ�еμӷ�̪��Һ�����������Լ��ԣ���ʹ��ɫ��̪��Һ��죬��ʵ������Ϊ���а�ɫ������������ɫ��̪��Һ��죻
ʵ�鲽��ٵ�Ŀ����ʹ̼������ȫ��Ӧ��������������Ƶļ���������ţ�
��4��ʵ������У�ͬѧ�Ƿ�������Ʒ�м�ˮʱ���ų��������ȣ�������������ˮ�ų��������ȣ���������ˮ��Ӧ�����������ƣ��ų��������ȣ�˵����Ʒ��������NaOH��CaO�е�һ�֡�
����D��

 ȫ�ŵ�����Ԫ�ƻ�ϵ�д�
ȫ�ŵ�����Ԫ�ƻ�ϵ�д�