题目内容
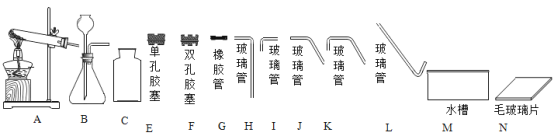
【题目】某同学配制 50g 溶质的质量分数为 15%的氯化钠溶液,整个操作过程如图所示,请回答下列问题。


(1)通过计算可知需要氯化钠的质量是_____g,
(2)该同学在称量过程中,发现指针偏右,接下来她应该进行的操作是_____;
(3)经检测,该同学所配制的溶液溶质的质量分数偏小,可能的原因是_____。
A 氯化钠固体不纯 B 用生锈的砝码称量
C 装瓶时有少量溶液洒出 D 溶解前烧杯中有少量的水
【答案】7.5 向左盘添加氯化钠,直至天平平衡 AD
【解析】
(1)溶质质量=溶液质量×溶质的质量分数,配制50g溶质的质量分数为15%的氯化钠溶液,需氯化钠的质量=50g×15%=7.5g;
(2)用托盘天平称量一定量药品,步骤应该是:先调好砝码和游码,再向左盘增减药品至天平平衡,然后向左边托盘添加药品;称量过程中发现指针偏右,说明药品的质量小于砝码的质量,故应进行的操作是继续向左盘添加药品,直至天平平衡;
(3)A、氯化钠固体不纯,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小;
B、用生锈砝码称量,会造成实际所取的溶质的质量偏大,则使溶质质量分数偏大;
C、溶液具有均一性,装瓶时有少量溶液洒出,溶质质量分数不变;
D、溶解前烧杯中有少量的水,会造成实际量取的水的体积偏大,则使溶质质量分数偏小。

 名校课堂系列答案
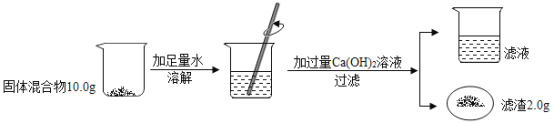
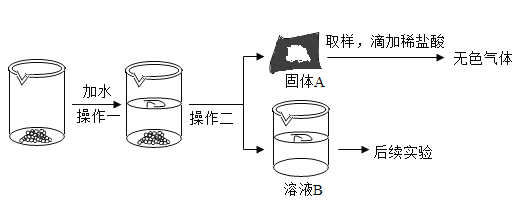
名校课堂系列答案【题目】CaO和NaOH固体的混合物,俗名“碱石灰”,实验室常用作干燥剂.碱石灰在空气久置会吸收空气中的水和二氧化碳而变质.某实验小组为确定一瓶久置的碱石灰样品的成分,设计了图所示实验流程.
请你参与探究过程:
(1)为了使样品充分溶解,操作一中还要用到的玻璃仪器是__;操作二的名称是__.
(2)固体A中一定含有__.
(3)溶液B成分的探究.
(查阅资料)
①Ca(OH)2、Na2CO3溶于水无明显的温度变化;
②Na2CO3溶液呈碱性,能使酚酞试液变红;
③CaCl2溶液呈中性且能与碳酸钠发生复分解反应.
(猜想)溶液B中溶质可能为:①NaOH ②Na2CO3③NaOH和Na2CO3④Ca(OH)2和__
(设计方案并进行实验)甲、乙同学分别设计如下方案并进行探究:
甲同学:取少量溶液B于试管中,滴加足量的稀盐酸,产生大量气泡,则溶液B中的溶质是Na2CO3.
乙同学:取少量溶液B于试管中,滴加几滴酚酞试液,溶液变成红色,则溶液B中的溶质一定含有NaOH.丙同学认真分析上述二位同学的实验,认为他们的结论均有不足之处,并且做出了正确的判断.他认为B溶液中一定含有Na2CO3,可能含有NaOH.为进一步确认溶液B中是否含NaOH,他做了如下实验.
实验步骤 | 实验现象 | 实验结论 |
①取少量溶液B于试管中,加入足量CaCl2溶液; ②过滤,在滤液中滴加酚酞试液 | __ | 猜想③正确 |
实验步骤①的目的是__.
(4)实验过程中,同学们发现向样品中加水时还放出大量的热.综合以上探究,下列对样品成分分析正确的是__(填序号).
A 一定有
B 一定有Na2CO3
C 一定有CaO
D 至少有NaOH、CaO中的一种.
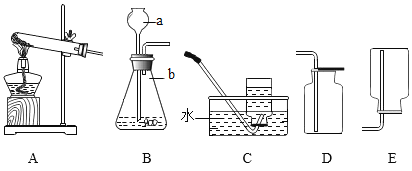
【题目】小明对铁的锈蚀进行如下探究.室温时,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,装置如图.观察到量筒内水沿导管慢慢进入净容积为146mL的广口瓶.当温度恢复至室温,且量筒内水面高度不再变化时读数.记录量筒起始和最终的读数以及所需时间如下表.
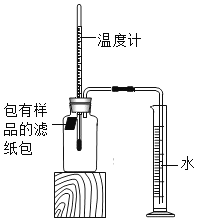
序号 | 样品 | 量筒起始 读数/mL | 量筒最终 读数/mL | 所需时间 /min |
① | 1g铁粉、0.2g碳和10滴水 | 100 | 78 | 约120 |
② | lg铁粉、0.2g碳、10滴水和少量NaCl | 100 | 78 | 约70 |
③ | / | / | / |
(1)实验①和②说明NaCl可以__ (填“加快”或“减慢”)铁锈蚀的速率.
(2)实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是__ (填“放热”或“吸热”)过程.
(3)实验后滤纸包中生成的新物质主要成分的化学式:__.
(4)实验①和③是探究碳对铁锈蚀速率的影响,填写实验③的样品组成:__.
(5)小明认为该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气的体积含量是__%(得数保留3位有效数字).
(6)为进一步验证(5)小题的实验结果,现仅提供:量筒、大烧杯、玻璃棒、水、滤纸包(内含铁粉、碳、水和NaCl),请你帮助小明再设计一个测量空气中氧气体积含量的实验方案______(可画简图表示).
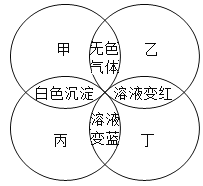
【题目】下面右图中,四圆甲、乙、丙、丁分别表示一种溶液,两圆的相交部分为两溶液混合后出现的主要实验现象,下表中符合图示关系的是
甲 | 乙 | 丙 | 丁 | |
A | Na2CO3 | H2SO4 | Ba(OH)2 | 石蕊 |
B | Na2CO3 | HCl | Ca(OH)2 | CuSO4 |
C | Na2SO4 | HCl | Ba(OH)2 | 石蕊 |
D | HCl | Na2CO3 | Ca(OH)2 | 酚酞 |
A.AB.BC.CD.D