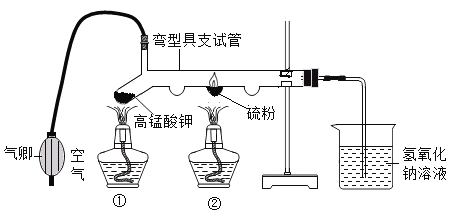
��Ŀ����
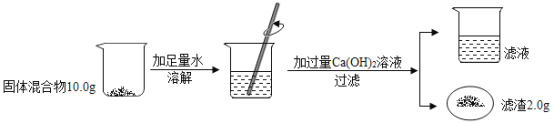
����Ŀ��ʵ���ϳ������������ķ�ˮ���辭���������ԣ�ij��ȤС��ͬѧ����һ����������������������Һ���������Է�ˮ��
��l�����Լ���ˮ������ˮ�����Եķ�����_______________________��
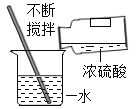
��2������200g��������Ϊ5.6%������������Һ
�ټ���m��KOH��=__________g��V��H2O��=______mL��ˮ���ܶȽ���Ϊ1.0gmL��1����
�ڳ�ȡ��������
����������ƽƽ���һֻ�ձ�����������ƽ�����̣�������������Ȼ��_____���������Ⱥ�˳������ĸ����ֱ����ƽƽ�⡣
a�����ձ��м��������ع��� b������Ҫ�������롢�ƶ�����
��3�������ⶨ��ˮ
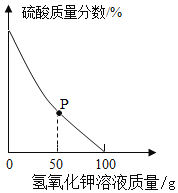
ȡ���Է�ˮ��Ʒ100g����μ���5.6%������������Һ����ˮ����������������仯��ͼ��ʾ���������ˮ�������ɷֲ����������ط�Ӧ�Ҳ�������أ�
��P���Ӧ��Һ��һ�����ڵ���������____�������ӷ��ţ���
�����Է�ˮ���������������Ϊ________���ðٷ�����ʾ��������0.1%����
�ۼ��㵱��ˮ����������ʱ����Һ������ص�����������д��������̣�����ðٷ�����ʾ��������0��l%����
���𰸡���1��ȡ������Һ���Թ��У��μӼ�����ɫʯ���Լ�����Һ��ɺ�ɫ��˵���÷�Һ������
��2����11.2����188.8��ba
��3����![]() ��
��![]() ��4.9%��4.4%
��4.9%��4.4%
��������
��l����ɫʯ���Լ��μӵ�������Һ�У���Һ���ɺ�ɫ�����Լ���ˮ������ˮ�����Եķ�����ȡ������Һ���Թ��У��μӼ�����ɫʯ���Լ�����Һ��ɺ�ɫ��˵���÷�Һ�����ԡ�
��2��Ҫ����200g��������Ϊ5.6%������������Һ�����У�
��![]() ����
����![]() ��
��
��![]() ��
��
�ڳ�ȡ�������أ�����������ƽƽ���һֻ�ձ�����������ƽ�����̣�������������Ȼ���Ȱ���Ҫ�������롢�ƶ����룬�����ձ��м���������ͬ��ֱ����ƽƽ�⣻���˳��Ϊba��
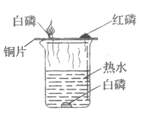
��3�������ⶨ��ˮ�����������������غ����ᷴӦ��������غ�ˮ�����У�
���������������ᷴӦ���������ƺ�ˮ����ͼ��ʾP������û����ȫ��Ӧ����Һ�е�����Ϊ���ᡢ����أ���˸õ��Ӧ��Һ��һ�����ڵ���������![]() ��
��![]() ��
��
��ͼ��ʾ����100g����������Һʱ��Һ�е�����ǡ����ȫ��Ӧ����Һ�����ԣ���μӷ�Ӧ�����������Ϊx�����ɵ�����ص�����Ϊy�����У�
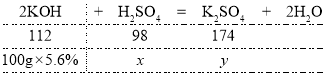
��![]() ���x=4.9g
���x=4.9g
��![]() ���y=8.7g
���y=8.7g
�����Է�ˮ���������������=![]()
�۵���ˮ����������ʱ����Һ������ص���������=![]()
�𣺢����Է�ˮ���������������Ϊ4.9%��
�۵���ˮ����������ʱ����Һ������ص���������Ϊ4.4%��

����Ŀ��CaO��NaOH����Ļ�����������ʯ������ʵ���ҳ��������������ʯ���ڿ������û����տ����е�ˮ�Ͷ�����̼�����ʣ�ijʵ��С��Ϊȷ��һƿ���õļ�ʯ����Ʒ�ijɷ֣������ͼ��ʾʵ�����̣�
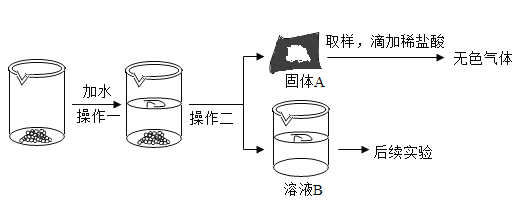
�������̽�����̣�
��1��Ϊ��ʹ��Ʒ����ܽ⣬����һ�л�Ҫ�õ��IJ���������__����������������__��
��2������A��һ������__��
��3����ҺB�ɷֵ�̽����
���������ϣ�
��Ca(OH)2��Na2CO3����ˮ�����Ե��¶ȱ仯��
��Na2CO3��Һ�ʼ��ԣ���ʹ��̪��Һ��죻
��CaCl2��Һ������������̼���Ʒ������ֽⷴӦ��
�����룩��ҺB�����ʿ���Ϊ����NaOH ��Na2CO3��NaOH��Na2CO3��Ca(OH)2��__
����Ʒ���������ʵ�飩�ס���ͬѧ�ֱ�������·���������̽����
��ͬѧ��ȡ������ҺB���Թ��У��μ�������ϡ���ᣬ�����������ݣ�����ҺB�е�������Na2CO3��
��ͬѧ��ȡ������ҺB���Թ��У��μӼ��η�̪��Һ����Һ��ɺ�ɫ������ҺB�е�����һ������NaOH����ͬѧ�������������λͬѧ��ʵ�飬��Ϊ���ǵĽ��۾��в���֮����������������ȷ���жϣ�����ΪB��Һ��һ������Na2CO3�����ܺ���NaOH��Ϊ��һ��ȷ����ҺB���Ƿ�NaOH������������ʵ�飮
ʵ�鲽�� | ʵ������ | ʵ����� |
��ȡ������ҺB���Թ��У���������CaCl2��Һ�� �ڹ��ˣ�����Һ�еμӷ�̪��Һ | __ | �������ȷ |
ʵ�鲽��ٵ�Ŀ����__��
��4��ʵ������У�ͬѧ�Ƿ�������Ʒ�м�ˮʱ���ų��������ȣ��ۺ�����̽�������ж���Ʒ�ɷַ�����ȷ����__������ţ���
A һ����
B һ����Na2CO3
C һ����CaO
D ������NaOH��CaO�е�һ�֣�