题目内容
为研究黄铜(铜锌合金)的组成,某学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止.生成的气体与所用硫酸溶液的质量关系如图所示,请计算: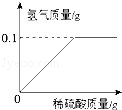
(1)10g样品中锌的质量是多少克?
(2)滴加的硫酸溶液质量是多少克?
(1)3.25g (2)50g
解析试题分析:
(1)设10g样品中锌的质量是X,滴加的硫酸溶液中溶质的质量是y
Zn+H2SO4=ZnSO4+H2↑
65 98 2
x y 0.1g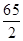 =
=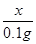 解得:X=3.25g
解得:X=3.25g =
=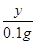 解得:y=4.9g
解得:y=4.9g
(2)滴加的硫酸溶液质量是: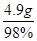 =50g
=50g
答:(1)10g样品中锌的质量是3.25克;(2)滴加的硫酸溶液质量是50克
考点:根据化学反应方程式的计算

练习册系列答案
相关题目
浓硫酸是化学实验室的一种常用试剂,小王同学在实验室里观察到一瓶浓硫酸的标签,如下图
| 浓硫酸(500ml) 相对分子质量 98 溶质质量分数 98% 密度 1.84克/毫升 |
(1)小王在取用时不小心把浓硫酸滴在纸上,发现纸很快变黑炭化,这是发生了 变化。
(2)实验室经常需要把浓硫酸稀释成稀硫酸来使用,若浓硫酸和水的体积按1:4的比例稀释,所得稀硫酸的溶质质量分数是多少?
(3)实验后,小王没有把浓硫酸的瓶盖拧紧,久置后这瓶浓硫酸的溶质质量分数会变小,这是因为浓硫酸具有 。
某环保小组监测到化工厂排放的废水中含有盐酸和氯化镁两种污染物,为测定该废水中各污染物的含量,环保小组进行了以下实验:
【实验一】取废水100g,向其中加入溶质质量分数为10%的氢氧化钠溶液。测得沉淀质量与所加入氢氧化钠溶液质量的关系如图。请根据实验及有关数据分析和计算: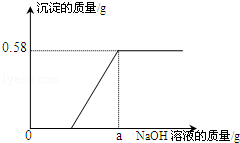
(1)向100g该废水中加入足量的氢氧化钠溶液时,产生的沉淀质量为 g。
(2)求该废水中氯化镁溶质的质量分数是多少?
【实验二】取三份废水各100g,分别缓慢加入到20g、40g和60g某硝酸银溶液中,测得三组实验数据见下表:
| | 第一组 | 第二组 | 第三组 |
| 硝酸银溶液的质量/g | 20 | 40 | 60 |
| 生成沉淀的质量/s | 2.870 | 5.740 | 7.175 |
(3)100g废水中加入硝酸银溶液的质量为 g时,可恰好完全反应。
(4)【实验一】图示中,a的数值为 。

