题目内容
【题目】根据下列反应事实写出相应的化学方程式。
(1)一氧化碳燃烧:____。
(2)用澄清石灰水检验二氧化碳:_____。
(3)铁和硫酸铜溶液:_____。
(4)高温煅烧石灰石:_____。
(5)用熟石灰改良含硫酸的酸性土壤:______。
【答案】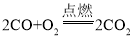 CO2+Ca(OH)2=CaCO3↓+H2O Fe+CuSO4=CuSO4+Fe
CO2+Ca(OH)2=CaCO3↓+H2O Fe+CuSO4=CuSO4+Fe 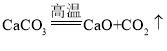 Ca(OH)2+H2SO4=CaSO4+2H2O
Ca(OH)2+H2SO4=CaSO4+2H2O
【解析】
(1)一氧化碳燃烧生成二氧化碳: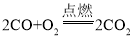 。
。
(2)用澄清石灰水检验二氧化碳,生成碳酸钙和水:CO2+Ca(OH)2=CaCO3↓+H2O。
(3)铁和硫酸铜溶液,生成硫酸亚铁和铜:Fe+CuSO4=CuSO4+Fe。
(4)高温煅烧石灰石,生成氧化钙和二氧化碳: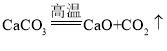 。
。
(5)用熟石灰改良含硫酸的酸性土壤,生成硫酸钙和水:Ca(OH)2+H2SO4=CaSO4+2H2O。

【题目】A 在 B 中充分燃烧生成 C 和 D,四种微观粒子的示意图如表所示:
(1)属于氧化物的是_____(填名称)。
物质 | A | B | C | D |
|
分子结构示意图 |
|
|
|
|
(2)A 在 B 中充分燃烧的化学方程式为_________;D 用于食品包装的填充气,是因为 D 的化学性质_____。
【题目】某同学将光亮的镁条放入滴有酚酞的 NaHCO3 饱和溶液中,产生大量气泡和白色固体,溶液红色加深。点燃产生的气体,火焰淡蓝色;将燃烧产物通入澄清石灰水中,无现象。过滤,将白色固体洗净、干燥。
(1)溶液红色加深,则反应后溶液的碱性_____(填“增强”、“不变”或“减弱”)。
(2)则该气体为_____(写化学式)。
(3)为确定白色固体的成分,该同学进行了如下的探究。
(查阅资料)Mg(HCO3)2 能溶于水;MgCO3、Mg(OH)2 加热易分解,都生成两种氧化物。
(提出猜测)白色固体是:Ⅰ.MgCO3;Ⅱ__________;Ⅲ.MgCO3和 Mg(OH)2。
(进行实验)
操作 | 现象 | 结论 |
①取白色固体于试管中,加入足量的稀盐酸 | 产生气泡,固体溶解 | 白色固体中一定含有_________(写名称) |
②称取干燥的白色固体 22.6 g 放在石棉网上充分加热 | 固体质量减少 |
(结论分析)
(4)据上述实验现象,小明认为猜想Ⅰ正确。但有同学认为小明的判断不严谨,因为猜想____也有相同现象。
(5)步骤①一定发生反应的化学方程式为:_____________________________。
(6)如要要确定白色固体的组成,还需要补充的操作是_____________________,再通过_______得出结论。