题目内容
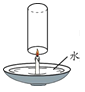
【题目】如图是配制100g溶质质量分数为5%的氯化钠溶液的操作过程。以下说法错误的是( )
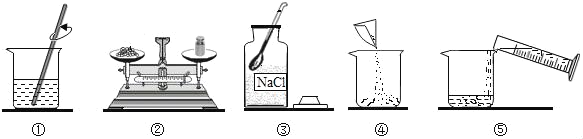
A. 该实验操作顺序为③②④⑤①
B. 称量时如果发现指针偏向右边,应向左盘添加氯化钠
C. 配制该溶液需称取5.0g氯化钠,量取20mL水
D. 操作①中玻璃棒的作用是搅拌,加速溶解
【答案】C
【解析】
A. 配制100g溶质质量分数为5%的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解,故该实验操作顺序为③②④⑤①,此选项正确;
B. 称量氯化钠时,步骤应该是:先调好砝码和游码,然后向左边托盘添加氯化钠;称量时如果发现指针偏向右边,说明食盐的质量小于砝码的质量,故应进行的操作是继续向左盘添加氯化钠,直至天平平衡,此选项正确;
C. 溶质质量=溶液质量×溶质的质量分数,配制100g溶质质量分数为5%的氯化钠溶液,需氯化钠的质量=100g×5%=5g;溶剂质量=溶液质量﹣溶质质量,则所需水的质量=100g﹣5g=95g(合95mL),此选项错误;
D. 操作①是溶解操作,玻璃棒的作用是搅拌,加速溶解,此选项正确。
故选:C。

【题目】在化学课上,甲同学将燃烧的钠迅速伸入到盛有CO2的集气瓶中,发现钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质。
(1)(提出问题)黑色颗粒和白色物质是什么?
(进行猜想)甲认为黑色颗粒是炭粒,白色物质可能是Na2O或_____;乙同学还认为白色物质是氢氧化钠。甲同学立刻认为乙同学的猜想是错误的,其理由是____。
(2)(查阅资料)①Na2O为白色固体,溶于水生成氢氧化钠:Na2O + H2O = 2NaOH;②CaCl2溶液显中性。
(实验探究)甲同学对白色物质进行实验探究。
实验方案 | 实 验 操 作 | 实验现象 | 结 论 |
方案1 | 取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
方案2 | ①取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 出现白色沉淀 | 白色物质是____。 |
②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
(3)(反思评价)丙同学认为方案1得到的结论不正确,理由是____。
(4)(得出结论)钠在二氧化碳中燃烧的化学方程式为____。
(5)(思维托展)通过以上探究,你还能获得哪些结论,请写出一条____。