题目内容
【题目】(1)如图是实验室制取和收集气体的一些常见的实验装置图,请根据图示回答下列问题:
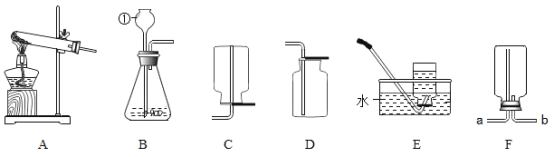
①实验室制取并收集二氧化碳应选用的装置是_________;通常检验二氧化碳气体的化学方程式为___________________________。
②若用F装置收集二氧化碳气体,气体应该由_________(填 “a”或“b”)端导入, 检验D装置中二氧化碳已收集满的方法是___________________________。
③在实验室中,常用加热固体氯化铵和氢氧化钙混合物的方法制氨气,若用此法制取氨气,应选用的发生装置是________________。
(2)钙元素是一种重要的金属元素,它可组成氯化钙、氢氧化钙等多种物质。
①氢化钙(CaH2)固体是登山运动员常用的能源提供剂。某实验探究小组的同学通过查阅资料得知,氢化钙在常温下能与水反应生成氢氧化钙和氢气,请你写出该反应的化学方程式_____________。
②该实验探究小组将Na2CO3溶液滴到Ca(OH)2 :溶液中充分反应后过滤,得到滤渣和滤液,经检验滤渣的成分是碳酸钙。
[提出问题]滤液中溶质的成分是什么?
[猜想与假设]猜想一:NaOH
猜想二:NaOH和Ca(OH)2
猜想三:NaOH和__________
猜想四:NaOH、Na2CO3和Ca(OH)2
经过讨论,大家认为猜想四不合理,原因是_____________________。
[实验过程]
实验步骤 | 现象 | 结论 |
步骤I:取滤液,向其中滴入适量Na2CO3溶液 | __________ | 猜想二不成立 |
步骤II:另取滤液,向其中加入足量__________溶液 | 产生气泡 | 猜想__________成立 |
【答案】BD CO2+Ca(OH)2=CaCO3↓+H2O b 将燃着的木条伸至集气瓶口 A CaH2+2H2O=Ca(OH)2+2H2↑ Na2CO3 Na2CO3和Ca(OH)2不能共存 无明显现象 盐酸 三
【解析】
(1)①实验室中制取二氧化碳常用大理石或石灰石和稀盐酸反应来制取,属于固液常温型,所以应该选择B装置来制取二氧化碳气体;常用澄清的石灰水检验二氧化碳气体,反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O。
②二氧化碳的密度比空气的大,若用F收集二氧化碳气体,气体应该由b端导入,将空气从长导管排出;检验D装置中二氧化碳己收集满的方法是将燃着的木条放在集气瓶口,若木条熄灭,说明已集满。
③在实验室中,常用加热固体氯化铵和氢氧化钙混合物的方法制氨气,属于固体加热型,应该选用的发生装置是A。
(2)①氢化钙(CaH2)在常温下和水反应生成氢氧化钙和氢气,化学方程式为:CaH2+2H2O=Ca(OH)2+2H2↑;
②[猜想与假设]
滤液中溶质的成分可能有如下几种情况:
①Na2CO3和Ca(OH)2恰好完全反应,滤液中的溶质是NaOH;
②当Na2CO3过量时,滤液中的溶质是:Na2CO3和NaOH;
③当氢氧化钙过量时,滤液中的溶质是:Ca(OH)2和NaOH;
猜想四不合理,原因是Na2CO3和Ca(OH)2不能共存,二者会反应生成碳酸钙沉淀和氢氧化钠;
[实验过程]
步骤I:碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,因为猜想二不成立,滤液中没有氢氧化钙,取滤液,向其中滴入适量Na2CO3溶液,无明显现象;
步骤II:因为现象是有气泡产生,另取滤液,向其中加入足量的盐酸,稀盐酸和碳酸钠反应生成氯化钠、水、二氧化碳,故根据现象可知滤液中含有Na2CO3和NaOH。

 阶梯计算系列答案
阶梯计算系列答案【题目】醉驾是危险驾驶罪,常用重铬酸钾(K2Cr2O7)在酸性环境下与乙醇反应来检测司机是否大量饮酒,化 学方程式为:![]() 。已知:
。已知:
CH3COOH | Cr(OH)3 | K2CrO4 | Cr2(SO4)3 | KCr(OH)4 | K2Cr2O7 |
无色 | 灰蓝色 | 黄 色 | 蓝紫色 | 绿 色 | 橙红色 |
易溶于水 | 难溶于水 | 易溶于水 | 易溶于水 | 易溶于水 | 易溶于水 |
(1)重铬酸钾酸性溶液检测出司机大量饮酒的现象是_______。
(2)硫酸铬Cr2(SO4)3与氢氧化钡反应的化学方程式_______,属于基本反应类型中的______反应。
(3)高锰酸铬中铬元素显+3价,请写出高锰酸铬化学式是______,属于_______。(填选项)
A 酸
B氧化物
C盐
D混合物
(4)下图是铬的原子结构示意图,请下列回答:
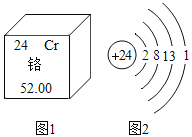
①铬的相对原子质量为_______;
②铬元素处于元素周期表中的第_______周期。