题目内容
【题目】醉驾是危险驾驶罪,常用重铬酸钾(K2Cr2O7)在酸性环境下与乙醇反应来检测司机是否大量饮酒,化 学方程式为:![]() 。已知:
。已知:
CH3COOH | Cr(OH)3 | K2CrO4 | Cr2(SO4)3 | KCr(OH)4 | K2Cr2O7 |
无色 | 灰蓝色 | 黄 色 | 蓝紫色 | 绿 色 | 橙红色 |
易溶于水 | 难溶于水 | 易溶于水 | 易溶于水 | 易溶于水 | 易溶于水 |
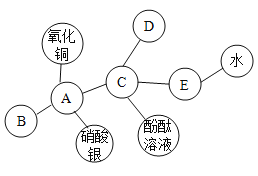
(1)重铬酸钾酸性溶液检测出司机大量饮酒的现象是_______。
(2)硫酸铬Cr2(SO4)3与氢氧化钡反应的化学方程式_______,属于基本反应类型中的______反应。
(3)高锰酸铬中铬元素显+3价,请写出高锰酸铬化学式是______,属于_______。(填选项)
A 酸
B氧化物
C盐
D混合物
(4)下图是铬的原子结构示意图,请下列回答:
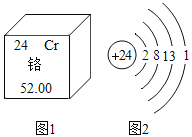
①铬的相对原子质量为_______;
②铬元素处于元素周期表中的第_______周期。
【答案】溶液由橙红色变蓝紫色 ![]() 复分解 Cr(MnO4)3 C 52.00 四(或4)
复分解 Cr(MnO4)3 C 52.00 四(或4)
【解析】
(1)橙红色重铬酸钾能与乙醇反应产生蓝紫色的硫酸铬,则重铬酸钾酸性溶液检测出司机大量饮酒的现象是:溶液由橙红色变蓝紫色;
(2)硫酸铬Cr2(SO4)3与氢氧化钡反应产生硫酸钡沉淀和氢氧化铬沉淀的化学方程式![]() ,该反应符合“两交换、价不变”属于基本反应类型中的复分解反应。
,该反应符合“两交换、价不变”属于基本反应类型中的复分解反应。
(3)高锰酸铬中铬元素显+3价,高锰酸根为-1价,则高锰酸铬化学式是Cr(MnO4)3,有铬离子和高锰酸根离子构成,属于盐类;
故选:C。
(4)①图例中正下方的数字表示相对原子质量,铬的相对原子质量为52.00;
②铬原子核外有4个电子层,电子层数=周期数,铬元素处于元素周期表中的第四周期。

【题目】化学课外活动小组在活动中,李老师做了一个趣味实验,将“锡纸”剪成一段两头宽中间窄的纸条,然后两头分别连接电池的正负极,一会儿观察到“锡纸”燃烧。小王同学产生了浓厚的兴趣,据此,小王同学与小组成员取某种“锡纸”进行了探究:
(1)“锡纸”燃烧的原因:“锡纸”两端接入电池两极后造成短路致使“锡纸”燃烧,从燃烧的条件分析:开始“锡纸”不燃烧但一会儿后却能燃烧的原因是________。
(2)探究“锡纸”中金属的成分:“ 锡纸”中的金属是锡吗?
[查阅资料]①“锡纸”是锡箔或铝箔和纸粘合而成;
②锌粉是一种深灰色固体
③锡(Sn)与酸或盐溶液反应生成+2价的锡盐
[提出猜想]猜想I:“锡纸”中的金属是锡;
猜想Ⅱ:“锡纸”中的金属是__________;
[进行实验]设计方案并进行实验
实验操作 | 实验现象 | 实验分析与结论 |
取打磨后的“锡纸”片放入试管中,滴加氯化锌溶液 | “锡纸”表面有深灰色固体析出 | 根据实验现象,结合金属活动性顺序可知猜想____ (填“I”或“II”) 成立;反应的化学方程式为_____。 |
[交流讨论]①实验中打磨“锡纸”的目的是___________;
②下列物质的溶液可以替代氯化锌溶液完成上述实验的是_____(填序号)。
A 氯化铜
B 硝酸银
C 硫酸钠
D 硫酸亚铁
[拓展应用]电器短路会引起火灾,我们要严加防范。如果电器着火应该采取的灭火方法是____。
【题目】CCTV1撒贝宁主持的《加油向未来》做过这样一个实验,专业人员将大块的钠扔入水中瞬间产生爆炸。小耿同学看到该节目后,他对钠产生了强烈的好奇。
(查阅资料)
①钠是一种活泼金属,常温下不与煤油反应,能与氧气、水,二氧化碳等物质发生反应。与水剧烈反应能生成一种可燃性气体与一种碱。
②密度:煤油0.8g/cm3,水1g/cm3,钠0.97g/cm3。钠一般保存在煤油中。
(实验探究)
老师启发下,小耿同学设计了如图1所示的一套钠与水反应的实验装置(夹持仪器已略)。
(实验步骤)①检查装置气密性;
②向大试管中加入一定体积煤油;
③用小刀切一小块钠,放入大试管,塞上橡皮塞;
④打开活塞,通过长颈漏斗向试管中加入水。使煤油的液面升至胶塞,关闭活塞观察现象。
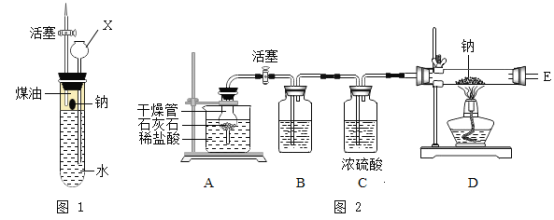
请回答下列问题:
(1)金属钠保存在煤油中的原因是__________________
(2)图1中,仪器X的名称是________
(3)实验结束打开活塞,将燃着的木条放到尖嘴处,发现气体被点燃,产生________色火焰,罩一个干冷的烧杯在火焰上方,烧杯内壁有水雾,生成的气体是___________(填化学式)。小季同学将图1试管中的水换成足量的硫酸铜溶液,观察到产生了气泡和一种蓝色沉淀。没有看到有红色的铜生成,根据实验探究和查阅资料了解到,金属钠先与硫酸铜溶液中的水反应,其化学方程式为______。
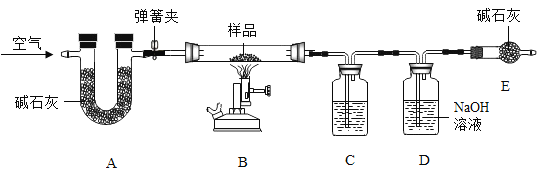
小杨在实验室中探究金属钠与二氧化碳的反应,选用如图2所示装置及药品进行实验。回答下列问题:
(4)打开活塞,制取CO2,实验室制取二氧化碳的化学方程式_______。为了得到干燥、纯净的CO2 ,B中盛有_______(填试剂名称)溶液。反应结束后,关闭活塞,干燥管内可观察到的现象是__________。用稀硫酸____(填“能”或者“不能”)代替稀盐酸。
(5)金属钠与二氧化碳反应的实验步骤及现象如下表:
操作步骤 | 实验现象 | |
1 | 打开活塞,待玻璃管中充满二氧化碳后,点燃酒精灯加热。 | 产生大量白烟,玻璃管壁上有黑色固体产生。 |
2 | 冷却后,将玻璃管中的固体全部取出,并置于试管中,加入适量的蒸馏水,振荡、过滤。 | 滤纸上留下黑色物质,滤液为无色溶液 |
①验证玻璃管中充满二氧化碳的方法是____________________ 。
②为检验玻璃管中白色物质的成分,取适量滤液于2支试管中,向一支试管中滴加1滴酚酞溶液,溶液变红;向第二支试管中滴加氢氧化钡溶液,溶液变浑浊。据此推断,白色物质中一定有的物质的化学式是______(填标号)。
A Na2O B Na2O2 C NaOH D Na2CO3
③经检验,滤纸上留下的黑色固体是一种单质,请写出它能与其他黑色固体反应的化学方程式:________________(任写一个)。
④本实验中金属钠与二氧化碳反应的化学方程式为 _______。
【题目】(1)如图是实验室制取和收集气体的一些常见的实验装置图,请根据图示回答下列问题:
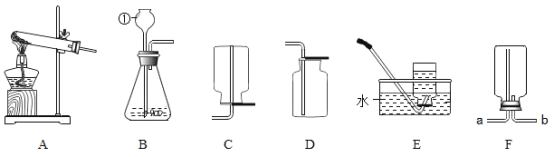
①实验室制取并收集二氧化碳应选用的装置是_________;通常检验二氧化碳气体的化学方程式为___________________________。
②若用F装置收集二氧化碳气体,气体应该由_________(填 “a”或“b”)端导入, 检验D装置中二氧化碳已收集满的方法是___________________________。
③在实验室中,常用加热固体氯化铵和氢氧化钙混合物的方法制氨气,若用此法制取氨气,应选用的发生装置是________________。
(2)钙元素是一种重要的金属元素,它可组成氯化钙、氢氧化钙等多种物质。
①氢化钙(CaH2)固体是登山运动员常用的能源提供剂。某实验探究小组的同学通过查阅资料得知,氢化钙在常温下能与水反应生成氢氧化钙和氢气,请你写出该反应的化学方程式_____________。
②该实验探究小组将Na2CO3溶液滴到Ca(OH)2 :溶液中充分反应后过滤,得到滤渣和滤液,经检验滤渣的成分是碳酸钙。
[提出问题]滤液中溶质的成分是什么?
[猜想与假设]猜想一:NaOH
猜想二:NaOH和Ca(OH)2
猜想三:NaOH和__________
猜想四:NaOH、Na2CO3和Ca(OH)2
经过讨论,大家认为猜想四不合理,原因是_____________________。
[实验过程]
实验步骤 | 现象 | 结论 |
步骤I:取滤液,向其中滴入适量Na2CO3溶液 | __________ | 猜想二不成立 |
步骤II:另取滤液,向其中加入足量__________溶液 | 产生气泡 | 猜想__________成立 |