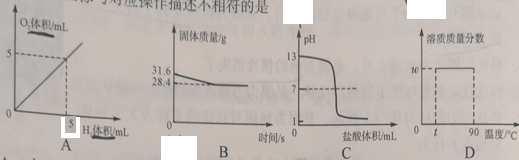
题目内容
【题目】某食盐样品中含少量MgCl2、CaCl2等杂质,由食盐样品制取纯净NaCl的过程如下:
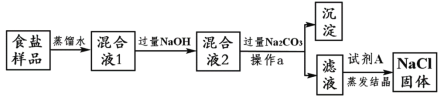
(1)操作a的名称是________,试剂A的名称是__________。
(2)加入过量的NaOH溶液,除去的离子是_______(填离子符号)。
(3)加入过量的Na2CO3溶液,所发生反应的化学方程式为____________。
(4)试剂A的作用是_________。
【答案】过滤 稀盐酸 Mg2+ Na2CO3 + CaCl2 = 2NaCl + CaCO3↓ 除去过量的NaOH和Na2CO3
【解析】
(1)操作a将沉淀与溶液进行了分离,能够分离难溶性固体与液体的混合物是过滤,即操作a为过滤,故填过滤;
由流程图可知,操作a---过滤后的滤液中除含有氯化钠外,还含有过量的氢氧化钠和碳酸钠,可以向滤液中加入适量的稀盐酸将氢氧化钠和碳酸钠除去得到氯化钠溶液,故填稀盐酸。
(2)加入的氢氧化钠溶液能够与氯化镁反应生成氢氧化镁沉淀和氯化钠,从而将杂质氯化镁转化为氯化钠,除去了原样品中的镁离子,1个镁离子带2个单位的正电荷,则其离子符号为Mg2+,故填Mg2+。
(3)加入过量的碳酸钠溶液能够与杂质氯化钙反应生成碳酸钙沉淀和氯化钠,故反应的化学方程式写为:Na2CO3 + CaCl2 = 2NaCl + CaCO3↓。
(4)由流程图可知,操作a---过滤后的滤液中除含有氯化钠外,还含有过量的氢氧化钠和碳酸钠,可以向滤液中加入适量的稀盐酸将氢氧化钠和碳酸钠除去得到氯化钠溶液,故填除去过量的NaOH和Na2CO3。

 名校课堂系列答案
名校课堂系列答案【题目】宜城葛洲坝水泥厂生产的水泥畅销各地,生产的原料之一是石灰石。某化学兴趣小组对石灰石纯度进行探究。取该石灰石样品16g,把200g稀盐酸分四次加入,测量探究过程所得数据见下表(已知石灰石样品中含有的杂质不溶于水也不与稀盐酸反应)。请计算:
序号 | 加入稀盐酸的质量/g | 剩余固体质量/g |
第1次 | 50 | 11 |
第2次 | 50 | 6 |
第3次 | 50 | 3.2 |
第4次 | 50 | m |
(1)表中m的数值为 ;石灰石纯度是 。
(2)求第2次反应完毕后所得溶液溶质的质量分数(写出解题过程,结果精确到0.1﹪)