��Ŀ����
����Ŀ��ij���Na2CO3����Ʒֻ�����������Ȼ������ʣ��ֳ�ȡ6g���������ձ��в�����ϡ���ᣬ��ϡ����μ���36.5gʱ���ձ�����Һ��������Ϊ40.3g������������ȫ���ݳ������ҵõ���������Һ����������������������ϡ�����������ϵ��ͼ��ʾ���Լ��㣺
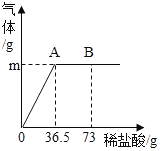
��1��m��ֵ��_____��
��2��B��ʱ���ձ�����Һ�����ʵĻ�ѧʽ_____��
��3���պ���ȫ��Ӧʱ��������Һ��������������____�������м�����̣������ȷ��0.1%����
���𰸡�2.2g NaCl��HCl 16.3%
��������
�⣺��1����ͼ���Կ�������������ﵽ36.5g��ʱ������ﵽ���������ǡ����ȫ��Ӧ�����������غ㶨�ɿɵã����ɵĶ�����̼������Ϊ6g+36.5g��40.3g��2.2g��
��2����B��ʱ�������Ѿ����������Դ�ʱ����Ϊ���ɵ��Ȼ��ƺ�ʣ������ᣬ�仯ѧʽ�ֱ�Ϊ��NaCl��HCl��
��3����μӷ�Ӧ��̼���Ƶ�����Ϊx�����ɵ��Ȼ��Ƶ�����Ϊy
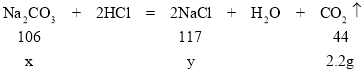
106��44=x��2.2g x��5.3g
117��44=y��2.2g y��5.85g
�պ���ȫ��Ӧʱ��������Һ��������������Ϊ![]() ��100%��16.3%
��100%��16.3%
�𣺣�1��m��ֵ��2.2g��
��2��B��ʱ���ձ�����Һ�����ʵĻ�ѧʽ NaCl��HCl��
��3���պ���ȫ��Ӧʱ��������Һ��������������Ϊ16.3%

����Ŀ�����㸡�����dz��õĻ�ѧ����������Ҫ�ɷ��ǹ���̼���ƣ�2Na2CO33H2O2��������ˮ��Ѹ������ˮ����������������缰��������ɻ��ʡ�ij��ѧ��ȤС������㸡�����Ļ�ѧ���ʡ�����ԭ��������̽����
���������ϣ�a.����̼���ƾ���̼���ƺ��������˫�����ʣ���ˮ��Һ�к���Na+��OH-��CO32-��H2O2��
b.Na+���ܴ���������ֽ⡣
c.��ͬ�¶��£�pH��ͬ����Һ��OH-��Ũ��Ҳ��ͬ��
̽��һ����̼���ƵĻ�ѧ����
ʵ�鲽�� | ʵ������ | ʵ����ͣ���ѧ����ʽ�� |
1��ȡ��������ˮ���μ�_______��Һ | �а�ɫ�������� | / |
2��ȡ��������ˮ������������̷�ĩ | _______ | _______ |
̽�������㸡��������ԭ��
��������⣩����̼������Һ�е��������Թ�������ֽ��д����ã�
��������裩����һ��CO32- �������OH-��������______________
��ʵ����̣���ͬ�¶��£�����H2O2��Һ�Լ�H2O2��Һ�зֱ��Na2CO3��NaOH��ʵ�飬�ⶨ��ͬʱ������Һ��pH���ܽ���������mg/L�����������£�
ʵ����� | 1 | 2 | 3 | 4 |
�Լ� | H2O2 | H2O2+Na2CO3 | H2O2+NaOH | H2O2+NaOH |
pH | 6.01 | 8.14 | 8.14 | 9.26 |
�ܽ��� | 6.44 | 9.11 | 9.11 | 10.97 |
��ʵ����ۣ��Ա�ʵ�����ݣ�֤������_______��ȷ��
����˼���������ʵ��2��3��Ŀ����_______��