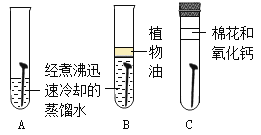
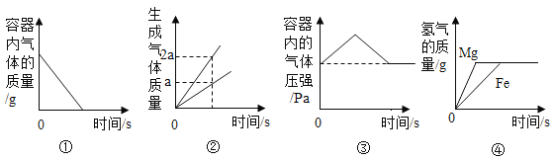
题目内容
【题目】A~H都是初中化学常见的物质,它们之间的转化关系如图所示。已知A、B均为黑色粉末;D、F均为红色固体,且D为单质;C能使澄清石灰水变浑浊。请回答:
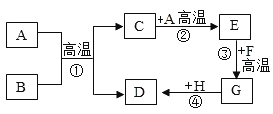
(1)A的化学式为:_____;E的名称为_____:C的固体俗称为_____。
(2)反应①的化学方程式为_____,该反应的现象为_____。
(3)反应②是_____反应(填“放热”或“吸热”),在③中E表现出_____性。
(4)请写出一个能实现反应④的化学方程式:_____。
【答案】C 一氧化碳 干冰 C+2CuO 2Cu+CO2↑ 黑色粉末逐渐变成亮红色 吸热 还原 Fe+CuSO4=FeSO4+Cu
2Cu+CO2↑ 黑色粉末逐渐变成亮红色 吸热 还原 Fe+CuSO4=FeSO4+Cu
【解析】
A﹣H都是初中化学常见的物质,C能使澄清石灰水变浑浊,所以C是二氧化碳,A、B均为黑色粉末,D、F均为红色固体,且D为单质,A、B高温会生成二氧化碳和D,所以D是铜,二氧化碳和A会生成E,所以A是碳,B是氧化铜,E是一氧化碳,一氧化碳和红色固体F反应会生成G,所以F是氧化铁,G是铁,铁和硫酸铜会生成硫酸亚铁和铜,经过验证,推导正确。
(1)A是碳,化学式为是C;E的名称为一氧化碳;C是二氧化碳,俗称为干冰;
(2)反应①是碳和氧化铜在高温的条件下生成铜和二氧化碳,化学方程式为:C+2CuO 2Cu+CO2↑,该反应的现象为:黑色粉末逐渐变成亮红色;
2Cu+CO2↑,该反应的现象为:黑色粉末逐渐变成亮红色;
(3)反应②是和碳在高温的条件下生成一氧化碳,属于吸热反应,在③中是一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,E表现出还原性;
(4)反应④可以是铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4=FeSO4+Cu。
故答案为:(1)C;一氧化碳;干冰;(2)C+2CuO 2Cu+CO2↑;黑色粉末逐渐变成亮红色;(3)吸热;还原;(4)Fe+CuSO4=FeSO4+Cu。
2Cu+CO2↑;黑色粉末逐渐变成亮红色;(3)吸热;还原;(4)Fe+CuSO4=FeSO4+Cu。

【题目】如图“黑面包”实验中,蔗糖(C12H22O11)变黑,体积膨胀,变成疏松的炭,放出有刺激性气味的气体。
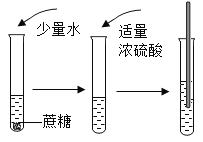
(提出问题)改变糖的种类、浓硫酸的体积、水的滴数和温度是否会影响实验效果呢?
(进行实验)分别取5g糖粉进行实验,根据前2 min的现象对实验效果进行评分,记录如下:
表1 实验记录
实验 | 糖 | 浓硫酸体积/mL | 水的滴数 | 温度/℃ | 效果得分 |
1 | 蔗糖 | 4 | 5 | 22 | 65 |
2 | 蔗糖 | 5 | 10 | 30 | 81 |
3 | 蔗糖 | 6 | 15 | 50 | 93 |
4 | 冰糖 | 4 | 10 | 50 | 91 |
5 | 冰糖 | 5 | 15 | 22 | 88 |
6 | 冰糖 | a | 5 | 30 | 75 |
7 | 葡萄糖 | 4 | 15 | 30 | 0 |
8 | 葡萄糖 | 5 | 5 | 50 | 0 |
9 | 葡萄糖 | 6 | 10 | 22 | 0 |
(处理数据)分析表1,计算效果得分均值,结果如下:
表2 效果得分均值
因素 | 糖 | 浓硫酸体积/mL | 水的滴数 | 温度/℃ | ||||||||
蔗糖 | 冰糖 | 葡萄糖 | 4 | 5 | 6 | 5 | 10 | 15 | 22 | 30 | 50 | |
均值 | 79.7 | 84.7 | 0 | 52.0 | 56.3 | 56.0 | 46.7 | 57.3 | 60.3 | 51.0 | 52.0 | 61.3 |
依据均值推断最佳实验方案,均值越高,效果越好。
(解释与结论)
(1)推测放出的气体含SO2,从元素守恒角度说明理由_____;
(2)实验6中,a为_____mL;
(3)根据表2推断,“黑面包”实验最好选择5 g冰糖、5 mL浓硫酸、_____滴水和50 ℃;
(反思与评价)
(4)表2中,22 ℃对应的均值为51.0,计算该值所依据的3个数据分别是_____;
(5)综合分析,使实验3的效果得分高于实验4的因素有_____。