题目内容
【题目】(1)某同学用市售浓盐酸(溶质质量分数为37%,密度为1.18gmL-1)配制800g溶质质量分数为10%的稀盐酸。通过计算可知需要浓盐酸 mL,水(密度lgmL-1) mL(上述两空答案都精确到0.1mL)
(2) 长期使用的热水锅炉会产生水垢。水垢主要成分是碳酸钙和氢氧化镁。某兴趣小组为了测定水垢中CaCO3的含量,将6g水垢粉碎后放在烧杯中,然后向其中加入40g某浓度的稀盐酸,使之充分反应(水垢中除碳酸钙和氢氧化镁外都不与稀盐酸反应)。实验数据记录如下:
反应时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
烧杯内所盛物质的总质量/g | 46.0 | 45.2 | 44.8 | 45.1 | 44.1 | 43.9 | 43.8 | 43.8 |
①表中有一数据是不合理的,该数据的测得时间是第 min。
②根据以上数据计算水垢中CaCO3的质量分数(计算结果精确至 0.1%)。
【答案】(1)183.2;583.8 (2) 3; 83.3%
【解析】
解:(1)需要浓盐酸的质量=![]() 216.2g,则需要盐酸的体积=
216.2g,则需要盐酸的体积=![]() ;
;
需要水的质量为800g-216.2g=583.8g,需要水的体积=![]() ;
;
(2)①表中有一数据是不合理的,该数据的测得时间是第3min,因为加入稀盐酸后固体质量依次减小,但第3min固体质量大于第2min的固体质量;
②根据表格提供的数据,第6min后烧杯内所盛物质的总质量不再发生变化,说明碳酸钙已反应完全。由质量守恒定律可知:产生二氧化碳的质量=6g+40g-43.8g=2.2g;
设:参加反应的碳酸钙的质量为x。
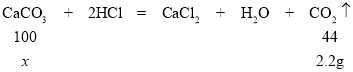
![]()
x=5g
故水垢中碳酸钙的质量分数=![]() 。
。

练习册系列答案
相关题目