题目内容
【题目】一定条件下,下列物质在密闭容器内充分反应,测得反应前后各物质的质量如下:
纯净物 | 乙醇 | 氧气 | 二氧化碳 | 水 | X |
反应前质量/g | 2.3 | 4 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 2.2 | 2.7 | 待测 |
A.反应后X的质量为1.5g B.X中一定含有碳元素和氧元素
C.X中一定含有碳元素和氢元素 D.X中两种元素的质量比是1:1
【答案】B
【解析】
在该反应中乙醇及氧气的质量减小,所以是反应物,二氧化碳和水质量增加是生成物,且参加反应的物质质量等于2.3g+4g=6.3g,而生成物二氧化碳和水的质量是2.2g+2.7g=4.9g,所以X是生成物,且质量是6.3g﹣4.9g=1.4g,其反应的表达式为乙醇+氧气→二氧化碳+水+X.
A、由以上分析知X等于1.4g;
B、2.3g乙醇中含有的碳元素质量是2.3g×![]() =1.2g,反应后二氧化碳中氧元素的质量是2.2g×
=1.2g,反应后二氧化碳中氧元素的质量是2.2g×![]() =1.6g,碳元素质量是2.2g﹣1.6g=0.6g,碳元素质量不等,所以X中一定含有碳元素,水中的氧元素是2.7g×
=1.6g,碳元素质量是2.2g﹣1.6g=0.6g,碳元素质量不等,所以X中一定含有碳元素,水中的氧元素是2.7g×![]() =2.4g,两者中氧元素的和与反应的氧气质量相等,因为乙醇中还含有氧元素,所以X中一定含有氧元素;
=2.4g,两者中氧元素的和与反应的氧气质量相等,因为乙醇中还含有氧元素,所以X中一定含有氧元素;
C、反应的乙醇中氢元素的质量是2.3g×![]() =0.3g,而水中的氢元素质量是2.7g×
=0.3g,而水中的氢元素质量是2.7g×![]() =0.3g所以X中不可能含有氢元素;
=0.3g所以X中不可能含有氢元素;
D、由以上分析知X中含有碳氧两种元素(1.2g﹣0.6g):2.3g×![]() =3:4;
=3:4;
故选B

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案
相关题目
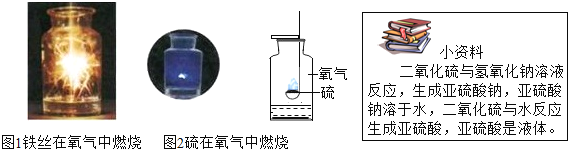
【题目】 “铁丝在氧气中燃烧”的装置如图所示,回答表格中的问题。
![]()
实验步骤 | (1)预先在集气瓶中放入少量水,其作用是 。 (2)待火柴快燃尽时,再将铁丝伸入盛有氧气的集气瓶中。 “火柴快要燃尽时再伸入集气瓶中”的目的是 。 |
实验现象 | 铁丝剧烈燃烧, ,放出大量热,生成一种黑色固体。 |
实验结论 | 该反应的化学方程式是 。 |