题目内容
 某兴趣小组对食用纯碱和食用小苏打两种粉末进行以下探究.
某兴趣小组对食用纯碱和食用小苏打两种粉末进行以下探究.
(一)【定性探究】
[查阅资料]
| 名称 | 食用纯碱 | 食用小苏打 |
| 主要成分 | Na2CO3 | NaHCO3 |
| 酸碱性 | 水溶液显碱性 | 水溶液显碱性 |
| 热稳定性 | 受热不分解 | 270℃时完全分解为碳酸钠、二氧化碳、水 |
(1)探究两者水溶液酸碱性的差异
小明分别向等浓度的两种溶液中滴入酚酞试液,发现两者都变________色,但食用纯碱溶液中颜色更深,由此推测可能________溶液碱性更强.小欢认为要比较两种溶液的碱性强弱,可直接用________进行测定.
(2)验证两种粉末的稳定性
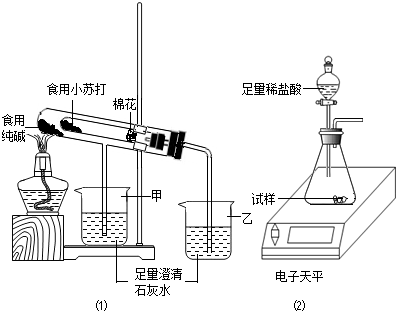
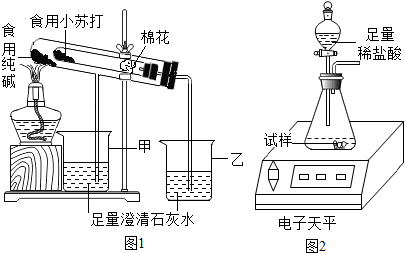
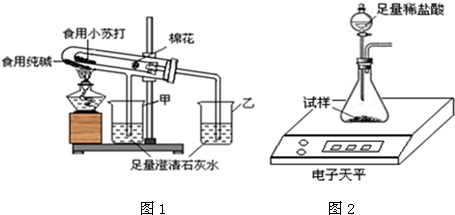
在老师的指导下,该小组按图1装置进行实验操作,观察到________(填“甲”或“乙”)烧杯中澄清石灰水变浑浊,试管中发生反应的化学方程式为________,装置中棉花的作用是________.
【拓展延伸】
(3)通过学习,我们知道小苏打(NaHCO3)除用于食品工业外,在日常生活及实验室中还有很多应用,试举一例:________.
(二)【定量探究】
(4)取食用纯碱粉末试样,利用图2装置进行实验测定,数据记录如下:
| 称量项目 | 称量时间 | 质量/g |
| 试样 | 11.0 | |
| 装置+稀盐酸 | 160.0 | |
| 装置+稀盐酸+试样 | 反应开始后20s | 167.0 |
| 装置+稀盐酸+试样 | 反应开始后30s | 166.6 |
| 装置+稀盐酸+试样 | 反应开始后90s | 166.6 |
②通过计算确定食用纯碱粉末中Na2CO3的质量分数为________%(结果保留一位小数)
③如果测得的结果比实际纯度高,可能的原因是________.(答一种即可)
解:(1)食用纯碱以及碳酸氢钠的水溶液都呈碱性,能使酚酞试液变红,食用纯碱溶液中颜色更深,说明纯碱的碱性比碳酸氢钠的碱性要强,测定溶液的pH可以使用pH试纸,故填:红,食用纯碱,pH试纸;
(2)碳酸氢钠受热能分解生成碳酸钠、水和二氧化碳,而碳酸钠受热不分解,故乙烧杯中的石灰水会变浑浊,在试管口放一团棉花能防止加热碳酸氢钠时其粉末随气流进行导管,故填:乙,2NaHCO3 Na2CO3+CO2↑+H2O,防止加热时小苏打粉末进入导管;
Na2CO3+CO2↑+H2O,防止加热时小苏打粉末进入导管;
(3)碳酸氢钠能与盐酸反应,可以用于治疗胃酸过多,故填:治疗胃酸过多;
(4)①生成二氧化碳的质量为:11.0g+160g-166.6g=4.4g,故填:4.4.
②设生成4.4g二氧化碳需要碳酸钠的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 4.4g
 x=10.6g
x=10.6g
食用纯碱粉末中Na2CO3的质量分数为: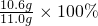 ≈96.4%
≈96.4%
故填:96.4;
③若计算的结果偏大,则可能是产生的二氧化碳中混有其他物质比如水蒸气或盐酸挥发出的氯化氢,导致二氧化碳的质量偏大,从而计算的碳酸钠的质量偏大的原因,故填:稀盐酸挥发出的HCl气体(或水蒸气)随CO2气体排出而导致所测纯度偏大.
分析:根据已有的知识进行分析,酚酞试液在碱性溶液中为红色,碱性溶液的pH越大,碱性越强;碳酸氢钠在加热时能分解生成碳酸钠、水和二氧化碳,根据碳酸钠与盐酸反应的质量变化,即可求出生成二氧化碳的质量以及计算碳酸钠的质量分数,据此解答即可.
点评:本题考查了碳酸钠的性质以及有关的计算,完成此题,可以依据已有的知识进行.
(2)碳酸氢钠受热能分解生成碳酸钠、水和二氧化碳,而碳酸钠受热不分解,故乙烧杯中的石灰水会变浑浊,在试管口放一团棉花能防止加热碳酸氢钠时其粉末随气流进行导管,故填:乙,2NaHCO3
 Na2CO3+CO2↑+H2O,防止加热时小苏打粉末进入导管;
Na2CO3+CO2↑+H2O,防止加热时小苏打粉末进入导管;(3)碳酸氢钠能与盐酸反应,可以用于治疗胃酸过多,故填:治疗胃酸过多;
(4)①生成二氧化碳的质量为:11.0g+160g-166.6g=4.4g,故填:4.4.
②设生成4.4g二氧化碳需要碳酸钠的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 4.4g
 x=10.6g
x=10.6g食用纯碱粉末中Na2CO3的质量分数为:
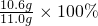 ≈96.4%
≈96.4%故填:96.4;
③若计算的结果偏大,则可能是产生的二氧化碳中混有其他物质比如水蒸气或盐酸挥发出的氯化氢,导致二氧化碳的质量偏大,从而计算的碳酸钠的质量偏大的原因,故填:稀盐酸挥发出的HCl气体(或水蒸气)随CO2气体排出而导致所测纯度偏大.
分析:根据已有的知识进行分析,酚酞试液在碱性溶液中为红色,碱性溶液的pH越大,碱性越强;碳酸氢钠在加热时能分解生成碳酸钠、水和二氧化碳,根据碳酸钠与盐酸反应的质量变化,即可求出生成二氧化碳的质量以及计算碳酸钠的质量分数,据此解答即可.
点评:本题考查了碳酸钠的性质以及有关的计算,完成此题,可以依据已有的知识进行.

练习册系列答案
相关题目
某兴趣小组对食用纯碱和食用小苏打两种粉末进行以下探究.
[查阅资料]
| 名称 | 食用纯碱 | 食用小苏打 |
| 主要成分 | Na2CO3 | NaHCO3 |
| 酸碱性 | 水溶液显碱性 | 水溶液显碱性 |
| 热稳定性 | 受热不分解 | 270℃时完全分解为碳酸钠、二氧化碳、水 |
[实验探究]
(1)探究两者水溶液酸碱性的差异
小明分别向等浓度的两种溶液中滴入酚酞试液,发现两者都变 色,但食用纯碱溶液中颜色更深,由此推测可能 溶液碱性更强.小欢认为要比较两种溶液的碱性强弱,可直接用 进行测定.
(2)验证两种粉末的稳定性
在老师的指导下,该小组按如图1装置进行实验操作,观察到 (填“甲”或“乙”)烧杯中澄清石灰水变浑浊,试管中发生反应的化学方程式为 ,装置中棉花的作用是 .
(3)测定食用纯碱粉末的纯度
取食用纯碱粉末试样,利用如图2装置进行实验测定.

数据记录如下:
| 称量项目 | 称量时间 | 质量/g |
| 试样 | 11.0 | |
| 装置+稀盐酸 | 160.0 | |
| 装置+稀盐酸+试样 | 反应开始后20s | 167.0 |
| 装置+稀盐酸+试样 | 反应开始后30s | 166.6 |
| 装置+稀盐酸+试样 | 反应开始后90s | 166.6 |
①反应生成CO2的质量为 g.
②通过计算确定食用纯碱粉末中Na2CO3的质量分数.(写出计算过程,结果保留一位小数.)
③如果测得的结果比实际纯度高,可能的原因是 .(答一种即可)