题目内容
(2009?宣武区二模)某固体混合物的主要成分有碳酸钙和氯化钙(氯化钙不与盐酸反应).为探究混合物中碳酸钙的质量分数,甲、乙两个小组同学分别进行了实验:(1)甲组同学按以下流程进行实验:
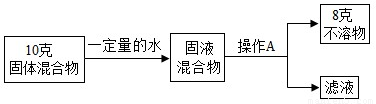
①操作A的名称______.
②混合物中碳酸钙的质量分数可能______80% 或______80%(填“>”、“<”或“=”).
(2)乙组的5名同学分别在一个质量为40.00的空烧杯中加入各自称好的固体混合物,然后将质量分数不同的36.50g稀盐酸加入烧杯中,实验数据如表:(假设反应过程中各物质均没有损失)
| 组号 | 烧杯及物质的总质量(g) | 稀盐酸溶质质量分数(%) | 产生气体的质量(g) |
| 1 | 42.00 | 2.00 | 0.44 |
| 2 | 45.00 | 5.00 | 1.10 |
| 3 | 44.00 | 9.50 | 1.32 |
| 4 | 46.00 | 9.50 | 1.98 |
| 5 | 44.00 | 6.00 | a |
【答案】分析:(1)①过滤是把溶性固体与液体分离的一种操作,操作后的固液混合物被分离为固体滤渣和滤液;
②过滤后的不溶物的质量若全部为碳酸钙的质量,则固体混合物中碳酸钙的质量分数恰好为80%;若所得不溶物不全部是碳酸钙,则固体混合物中碳酸钙的质量分数小于80%;
(2)对比所得实验数据,1、3对比可得知36.5g2%的稀盐酸完全反应可生成0.44g二氧化碳、4g固体混合物完全反应可生成气体二氧化碳1.32g,并且可推断得出4g固体混合物完全反应需要消耗6%的稀盐酸36.5g.
解答:解:(1)①A操作后原固液混合物被分离为固体不溶物和滤液,因此,操作A为过滤操作;
故答案为:过滤;
②过滤后的固体若未经洗涤、干燥处理,不溶物若附着溶液,所称量不溶物的质量8g不全部为碳酸钙的质量,则固体混合物中碳酸钙的质量分数小于80%;若过滤所得的不溶物质量8g全部为碳酸钙的质量,则固体混合物中碳酸钙的质量分数等于80%;
故答案为:<;=;
(2)1、3组数据对比,3组所用药品固体混合物质量增加至2倍,稀盐酸的质量增加至4.75倍,而放出二氧化碳的质量增加至三倍,此现象可说明1组中的固体混合物、3组中稀盐酸未完全反应有剩余,则2%的稀盐酸全部反应产生0.44g气体二氧化碳、4g固体混合物完全反应可生成二氧化碳1.32g;根据此质量关系,5组所取固体混合物和稀盐酸恰好完全反应,生成二氧化碳的质量为1.32g;
故答案为:1.32.
点评:利用各组实验数据中生成二氧化碳的比例关系与所加稀盐酸、固体混合物的质量比例关系,判断物质间的反应关系.
②过滤后的不溶物的质量若全部为碳酸钙的质量,则固体混合物中碳酸钙的质量分数恰好为80%;若所得不溶物不全部是碳酸钙,则固体混合物中碳酸钙的质量分数小于80%;
(2)对比所得实验数据,1、3对比可得知36.5g2%的稀盐酸完全反应可生成0.44g二氧化碳、4g固体混合物完全反应可生成气体二氧化碳1.32g,并且可推断得出4g固体混合物完全反应需要消耗6%的稀盐酸36.5g.
解答:解:(1)①A操作后原固液混合物被分离为固体不溶物和滤液,因此,操作A为过滤操作;
故答案为:过滤;
②过滤后的固体若未经洗涤、干燥处理,不溶物若附着溶液,所称量不溶物的质量8g不全部为碳酸钙的质量,则固体混合物中碳酸钙的质量分数小于80%;若过滤所得的不溶物质量8g全部为碳酸钙的质量,则固体混合物中碳酸钙的质量分数等于80%;
故答案为:<;=;
(2)1、3组数据对比,3组所用药品固体混合物质量增加至2倍,稀盐酸的质量增加至4.75倍,而放出二氧化碳的质量增加至三倍,此现象可说明1组中的固体混合物、3组中稀盐酸未完全反应有剩余,则2%的稀盐酸全部反应产生0.44g气体二氧化碳、4g固体混合物完全反应可生成二氧化碳1.32g;根据此质量关系,5组所取固体混合物和稀盐酸恰好完全反应,生成二氧化碳的质量为1.32g;
故答案为:1.32.
点评:利用各组实验数据中生成二氧化碳的比例关系与所加稀盐酸、固体混合物的质量比例关系,判断物质间的反应关系.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
(2009?宣武区二模)酸、碱、盐是三类重要物质.
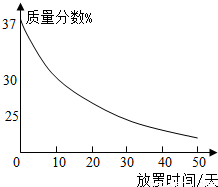
(1)实验室中有一瓶敞口放置的浓盐酸.它的质量分数和放置天数的关系如图.假设水不蒸发,分析浓盐酸的溶质质量分数变化的原因.
(2)观察图片,向小试管内滴加水后,除看到氧化钙固体溶解外,还可观察到的现象是.解释产生此现象的原因;.

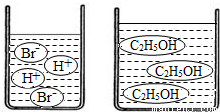
(3)如图分别是溴化氢(HBr)和乙醇(C2H5OH)在水中的微观示意图.请你结合已有的酸、碱知识,判断溴化氢的水溶液显,乙醇的水溶液显(填“酸性”、“中性”或“碱性”).
(4)向盛有10mL稀盐酸(其中滴有少量指示剂)的烧杯中加入氢氧化钠溶液,用pH计测定溶液的pH,所得数据如下.请分析并回答下列问题:
①若滴加的指示剂是紫色石蕊溶液,当加入氢氧化钠溶液的体积为13mL时,溶液显色.
②若滴加指示剂是无色酚酞溶液,入氢氧化钠溶液充分振荡后,溶液颜色无变化.此时溶液中的溶质一定有(填化学式);可能有.
(1)实验室中有一瓶敞口放置的浓盐酸.它的质量分数和放置天数的关系如图.假设水不蒸发,分析浓盐酸的溶质质量分数变化的原因.

(2)观察图片,向小试管内滴加水后,除看到氧化钙固体溶解外,还可观察到的现象是.解释产生此现象的原因;.

(3)如图分别是溴化氢(HBr)和乙醇(C2H5OH)在水中的微观示意图.请你结合已有的酸、碱知识,判断溴化氢的水溶液显,乙醇的水溶液显(填“酸性”、“中性”或“碱性”).

(4)向盛有10mL稀盐酸(其中滴有少量指示剂)的烧杯中加入氢氧化钠溶液,用pH计测定溶液的pH,所得数据如下.请分析并回答下列问题:
| 加入NaOH溶液的体积/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | |
| 烧杯中溶液的pH | 1.1 | 1.2 | 1.4 | 1.6 | 2.5 | 7.0 | 11.0 | 12.0 |
②若滴加指示剂是无色酚酞溶液,入氢氧化钠溶液充分振荡后,溶液颜色无变化.此时溶液中的溶质一定有(填化学式);可能有.
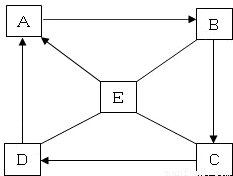 (2009?宣武区二模)A~E是初中化学常见的五种物质,有如下图的转化关系.A是生命之源.“-”表示两端的物质能反应,“→”表示物质间存在转化关系.(部分生成物和反应条件已略去)
(2009?宣武区二模)A~E是初中化学常见的五种物质,有如下图的转化关系.A是生命之源.“-”表示两端的物质能反应,“→”表示物质间存在转化关系.(部分生成物和反应条件已略去)