题目内容
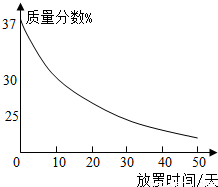
(2009?宣武区二模)酸、碱、盐是三类重要物质.(1)实验室中有一瓶敞口放置的浓盐酸.它的质量分数和放置天数的关系如图.假设水不蒸发,分析浓盐酸的溶质质量分数变化的原因.
(2)观察图片,向小试管内滴加水后,除看到氧化钙固体溶解外,还可观察到的现象是.解释产生此现象的原因;.

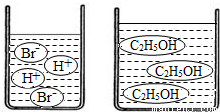
(3)如图分别是溴化氢(HBr)和乙醇(C2H5OH)在水中的微观示意图.请你结合已有的酸、碱知识,判断溴化氢的水溶液显,乙醇的水溶液显(填“酸性”、“中性”或“碱性”).
(4)向盛有10mL稀盐酸(其中滴有少量指示剂)的烧杯中加入氢氧化钠溶液,用pH计测定溶液的pH,所得数据如下.请分析并回答下列问题:
| 加入NaOH溶液的体积/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | |
| 烧杯中溶液的pH | 1.1 | 1.2 | 1.4 | 1.6 | 2.5 | 7.0 | 11.0 | 12.0 |
②若滴加指示剂是无色酚酞溶液,入氢氧化钠溶液充分振荡后,溶液颜色无变化.此时溶液中的溶质一定有(填化学式);可能有.
【答案】分析:(1)分析图中盐酸的溶质质量分数随时间延长的变化情况,结合浓盐酸的挥发性,对这一现象进行解释;
(2)根据氧化钙遇水放出大量热,放出的热量可使装置内空气受热膨胀,也可使饱和溶液石灰水溶液温度升高,结合氢氧化钙的溶解性,预计会出现的现象并说明原因;
(3)溶液中含有H+,溶液呈酸性;溶液中含OH-,溶液则呈碱性;由图所示,根据溶液中粒子,判断两溶液的酸碱性;
(4)①由数据表,判断随着向稀盐酸中滴加氢氧化钠溶液pH的变化,根据变化规律,判断当加入氢氧化钠溶液的体积为13mL时,溶液的酸碱性及紫色石蕊的变色情况;
②酚酞遇酸或中性溶液均为无色,只有遇到碱性溶液才呈红色;根据酚酞的颜色,推断溶液中反应情况,判断溶液中溶质.
解答:解:(1)图示表明,随时间延长盐酸的质量分数逐渐减小,这可用浓盐酸具有易挥发的性质加以解释:随HCl不断挥发,溶液中溶质质量减小;
(2)氧化钙遇水放出大量热,试管内空气受热膨胀,导管与之相通的U型管内两侧液面出现改变,红墨水的液面乙高于甲;放出的热量使大试管内盛放的饱和溶液温度升高,由于氢氧化钙溶解度随温度升高而减小,饱和溶液会因升温而析出固体,可观察到石灰水变浑浊;
(3)由图示可知,溴化氢的水溶液中含有H+,因此溶液呈酸性;而乙醇溶液中既不含H+也不含OH-,因此溶液呈中性;
(4)①紫色石蕊遇碱性溶液变成蓝色,根据表中数据可知,当滴入10mL氢氧化钠溶液中恰好完全反应,溶液呈中性;因此滴入13mL氢氧化钠溶液时,因氢氧化钠过量而使溶液呈碱性,因此紫色石蕊呈现蓝色;
②滴入一定量氢氧化钠溶液后,酚酞仍为无色,可推断此时的溶液可能含有未反应完的盐酸而呈酸性,或恰好完全反应而呈中性;因此,此时溶液中一定含反应生成的氯化钠,可能含有未完全反应的盐酸;
故答案为:
(1)浓盐酸易挥发;
(2)红墨水的液面乙高于甲、澄清石灰水变浑浊;氧化钙与水反应放热使试管内的气体受热膨胀;氢氧化钙的溶解度随温度的升高而降低,一部分氢氧化钙固体析出;
(3)酸性;中性;
(4)①蓝;②NaCl;HCl.
点评:根据对图示或实验数据的分析,科学地推断所发生变化的情况,这是解决本题所要认真关注的.
(2)根据氧化钙遇水放出大量热,放出的热量可使装置内空气受热膨胀,也可使饱和溶液石灰水溶液温度升高,结合氢氧化钙的溶解性,预计会出现的现象并说明原因;
(3)溶液中含有H+,溶液呈酸性;溶液中含OH-,溶液则呈碱性;由图所示,根据溶液中粒子,判断两溶液的酸碱性;
(4)①由数据表,判断随着向稀盐酸中滴加氢氧化钠溶液pH的变化,根据变化规律,判断当加入氢氧化钠溶液的体积为13mL时,溶液的酸碱性及紫色石蕊的变色情况;
②酚酞遇酸或中性溶液均为无色,只有遇到碱性溶液才呈红色;根据酚酞的颜色,推断溶液中反应情况,判断溶液中溶质.
解答:解:(1)图示表明,随时间延长盐酸的质量分数逐渐减小,这可用浓盐酸具有易挥发的性质加以解释:随HCl不断挥发,溶液中溶质质量减小;
(2)氧化钙遇水放出大量热,试管内空气受热膨胀,导管与之相通的U型管内两侧液面出现改变,红墨水的液面乙高于甲;放出的热量使大试管内盛放的饱和溶液温度升高,由于氢氧化钙溶解度随温度升高而减小,饱和溶液会因升温而析出固体,可观察到石灰水变浑浊;
(3)由图示可知,溴化氢的水溶液中含有H+,因此溶液呈酸性;而乙醇溶液中既不含H+也不含OH-,因此溶液呈中性;
(4)①紫色石蕊遇碱性溶液变成蓝色,根据表中数据可知,当滴入10mL氢氧化钠溶液中恰好完全反应,溶液呈中性;因此滴入13mL氢氧化钠溶液时,因氢氧化钠过量而使溶液呈碱性,因此紫色石蕊呈现蓝色;
②滴入一定量氢氧化钠溶液后,酚酞仍为无色,可推断此时的溶液可能含有未反应完的盐酸而呈酸性,或恰好完全反应而呈中性;因此,此时溶液中一定含反应生成的氯化钠,可能含有未完全反应的盐酸;
故答案为:
(1)浓盐酸易挥发;
(2)红墨水的液面乙高于甲、澄清石灰水变浑浊;氧化钙与水反应放热使试管内的气体受热膨胀;氢氧化钙的溶解度随温度的升高而降低,一部分氢氧化钙固体析出;
(3)酸性;中性;
(4)①蓝;②NaCl;HCl.
点评:根据对图示或实验数据的分析,科学地推断所发生变化的情况,这是解决本题所要认真关注的.

练习册系列答案
相关题目
(2009?宣武区二模)某固体混合物的主要成分有碳酸钙和氯化钙(氯化钙不与盐酸反应).为探究混合物中碳酸钙的质量分数,甲、乙两个小组同学分别进行了实验:
(1)甲组同学按以下流程进行实验:
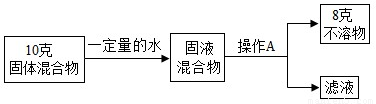
①操作A的名称______.
②混合物中碳酸钙的质量分数可能______80% 或______80%(填“>”、“<”或“=”).
(2)乙组的5名同学分别在一个质量为40.00的空烧杯中加入各自称好的固体混合物,然后将质量分数不同的36.50g稀盐酸加入烧杯中,实验数据如表:(假设反应过程中各物质均没有损失)
表中a=______g.
(1)甲组同学按以下流程进行实验:

①操作A的名称______.
②混合物中碳酸钙的质量分数可能______80% 或______80%(填“>”、“<”或“=”).
(2)乙组的5名同学分别在一个质量为40.00的空烧杯中加入各自称好的固体混合物,然后将质量分数不同的36.50g稀盐酸加入烧杯中,实验数据如表:(假设反应过程中各物质均没有损失)
| 组号 | 烧杯及物质的总质量(g) | 稀盐酸溶质质量分数(%) | 产生气体的质量(g) |
| 1 | 42.00 | 2.00 | 0.44 |
| 2 | 45.00 | 5.00 | 1.10 |
| 3 | 44.00 | 9.50 | 1.32 |
| 4 | 46.00 | 9.50 | 1.98 |
| 5 | 44.00 | 6.00 | a |
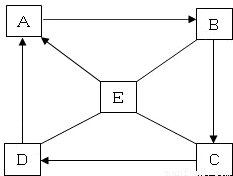 (2009?宣武区二模)A~E是初中化学常见的五种物质,有如下图的转化关系.A是生命之源.“-”表示两端的物质能反应,“→”表示物质间存在转化关系.(部分生成物和反应条件已略去)
(2009?宣武区二模)A~E是初中化学常见的五种物质,有如下图的转化关系.A是生命之源.“-”表示两端的物质能反应,“→”表示物质间存在转化关系.(部分生成物和反应条件已略去)