题目内容
(2009?宣武区二模)根据图片回答以下问题.
(1)仪器a的名称______;A装置的实验现象______;写出反应的化学方程式______ 2P2O5
【答案】分析:(1)了解常见仪器,观察图示并了解红磷燃烧的现象以及大气压强的作用;会书写红磷燃烧的化学方程式.
(2)了解二氧化碳与水的反应,以及石蕊试液的作用;
(3)观察图示了解一氧化碳的作用,书写氧化铁与一氧化碳的反应式.
解答:解:熟悉常见仪器,如A装置中的a是广口瓶;A装置中的红磷点燃后燃烧,并冒白烟.红磷的燃烧需要消耗广口瓶内的氧气,广口瓶内的氧气被消耗后,压强变小,在外界大气压强的作用下烧杯内的水沿着导管进入广口瓶.又由于氧气的体积占空气体积的 ,所以水流入广口瓶内的体积约占广口瓶体积的
,所以水流入广口瓶内的体积约占广口瓶体积的 .红磷在空气中的燃烧化学式为:4P+5O2
.红磷在空气中的燃烧化学式为:4P+5O2 2P2O5.故答案为:广口瓶(集气瓶)、红磷燃烧,冒白烟,水流入广口瓶、流入的体积约为广口瓶容积的
2P2O5.故答案为:广口瓶(集气瓶)、红磷燃烧,冒白烟,水流入广口瓶、流入的体积约为广口瓶容积的 、4P+5O2
、4P+5O2 2P2O5
2P2O5
(2)石蕊试液遇酸变红,利用这一性质可检验检验二氧化碳与水反应的产物显酸性.故答案为:二氧化碳与水能否发生化学反应(验证二氧化碳与水反应的产物显酸性)
(3)观察图形可知,此装置是用一氧化碳还原氧化铁的试验.我们可以观察到红色的氧化铁粉末变成黑色.铁本应是银白色,由于高温的作用铁的表面又被氧化了,所以是黑色的.反应式为:Fe2O3+3CO 2Fe+3CO2.故答案为:红色粉末变成黑色、Fe2O3+3CO
2Fe+3CO2.故答案为:红色粉末变成黑色、Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
点评:本题通过试验装置考查红磷的燃烧的现象、石蕊试液的作用一氧化碳的还原性.使学生的总和化学知识得到进一步的提高.
(2)了解二氧化碳与水的反应,以及石蕊试液的作用;
(3)观察图示了解一氧化碳的作用,书写氧化铁与一氧化碳的反应式.
解答:解:熟悉常见仪器,如A装置中的a是广口瓶;A装置中的红磷点燃后燃烧,并冒白烟.红磷的燃烧需要消耗广口瓶内的氧气,广口瓶内的氧气被消耗后,压强变小,在外界大气压强的作用下烧杯内的水沿着导管进入广口瓶.又由于氧气的体积占空气体积的
 ,所以水流入广口瓶内的体积约占广口瓶体积的
,所以水流入广口瓶内的体积约占广口瓶体积的 .红磷在空气中的燃烧化学式为:4P+5O2
.红磷在空气中的燃烧化学式为:4P+5O2 2P2O5.故答案为:广口瓶(集气瓶)、红磷燃烧,冒白烟,水流入广口瓶、流入的体积约为广口瓶容积的
2P2O5.故答案为:广口瓶(集气瓶)、红磷燃烧,冒白烟,水流入广口瓶、流入的体积约为广口瓶容积的 、4P+5O2
、4P+5O2 2P2O5
2P2O5(2)石蕊试液遇酸变红,利用这一性质可检验检验二氧化碳与水反应的产物显酸性.故答案为:二氧化碳与水能否发生化学反应(验证二氧化碳与水反应的产物显酸性)
(3)观察图形可知,此装置是用一氧化碳还原氧化铁的试验.我们可以观察到红色的氧化铁粉末变成黑色.铁本应是银白色,由于高温的作用铁的表面又被氧化了,所以是黑色的.反应式为:Fe2O3+3CO
 2Fe+3CO2.故答案为:红色粉末变成黑色、Fe2O3+3CO
2Fe+3CO2.故答案为:红色粉末变成黑色、Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2点评:本题通过试验装置考查红磷的燃烧的现象、石蕊试液的作用一氧化碳的还原性.使学生的总和化学知识得到进一步的提高.

练习册系列答案
相关题目
(2009?宣武区二模)某固体混合物的主要成分有碳酸钙和氯化钙(氯化钙不与盐酸反应).为探究混合物中碳酸钙的质量分数,甲、乙两个小组同学分别进行了实验:
(1)甲组同学按以下流程进行实验:

①操作A的名称______.
②混合物中碳酸钙的质量分数可能______80% 或______80%(填“>”、“<”或“=”).
(2)乙组的5名同学分别在一个质量为40.00的空烧杯中加入各自称好的固体混合物,然后将质量分数不同的36.50g稀盐酸加入烧杯中,实验数据如表:(假设反应过程中各物质均没有损失)
表中a=______g.
(1)甲组同学按以下流程进行实验:

①操作A的名称______.
②混合物中碳酸钙的质量分数可能______80% 或______80%(填“>”、“<”或“=”).
(2)乙组的5名同学分别在一个质量为40.00的空烧杯中加入各自称好的固体混合物,然后将质量分数不同的36.50g稀盐酸加入烧杯中,实验数据如表:(假设反应过程中各物质均没有损失)
| 组号 | 烧杯及物质的总质量(g) | 稀盐酸溶质质量分数(%) | 产生气体的质量(g) |
| 1 | 42.00 | 2.00 | 0.44 |
| 2 | 45.00 | 5.00 | 1.10 |
| 3 | 44.00 | 9.50 | 1.32 |
| 4 | 46.00 | 9.50 | 1.98 |
| 5 | 44.00 | 6.00 | a |
(2009?宣武区二模)酸、碱、盐是三类重要物质.
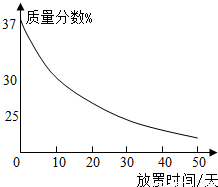
(1)实验室中有一瓶敞口放置的浓盐酸.它的质量分数和放置天数的关系如图.假设水不蒸发,分析浓盐酸的溶质质量分数变化的原因.
(2)观察图片,向小试管内滴加水后,除看到氧化钙固体溶解外,还可观察到的现象是.解释产生此现象的原因;.

(3)如图分别是溴化氢(HBr)和乙醇(C2H5OH)在水中的微观示意图.请你结合已有的酸、碱知识,判断溴化氢的水溶液显,乙醇的水溶液显(填“酸性”、“中性”或“碱性”).

(4)向盛有10mL稀盐酸(其中滴有少量指示剂)的烧杯中加入氢氧化钠溶液,用pH计测定溶液的pH,所得数据如下.请分析并回答下列问题:
①若滴加的指示剂是紫色石蕊溶液,当加入氢氧化钠溶液的体积为13mL时,溶液显色.
②若滴加指示剂是无色酚酞溶液,入氢氧化钠溶液充分振荡后,溶液颜色无变化.此时溶液中的溶质一定有(填化学式);可能有.
(1)实验室中有一瓶敞口放置的浓盐酸.它的质量分数和放置天数的关系如图.假设水不蒸发,分析浓盐酸的溶质质量分数变化的原因.

(2)观察图片,向小试管内滴加水后,除看到氧化钙固体溶解外,还可观察到的现象是.解释产生此现象的原因;.

(3)如图分别是溴化氢(HBr)和乙醇(C2H5OH)在水中的微观示意图.请你结合已有的酸、碱知识,判断溴化氢的水溶液显,乙醇的水溶液显(填“酸性”、“中性”或“碱性”).

(4)向盛有10mL稀盐酸(其中滴有少量指示剂)的烧杯中加入氢氧化钠溶液,用pH计测定溶液的pH,所得数据如下.请分析并回答下列问题:
| 加入NaOH溶液的体积/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | |
| 烧杯中溶液的pH | 1.1 | 1.2 | 1.4 | 1.6 | 2.5 | 7.0 | 11.0 | 12.0 |
②若滴加指示剂是无色酚酞溶液,入氢氧化钠溶液充分振荡后,溶液颜色无变化.此时溶液中的溶质一定有(填化学式);可能有.
 (2009?宣武区二模)A~E是初中化学常见的五种物质,有如下图的转化关系.A是生命之源.“-”表示两端的物质能反应,“→”表示物质间存在转化关系.(部分生成物和反应条件已略去)
(2009?宣武区二模)A~E是初中化学常见的五种物质,有如下图的转化关系.A是生命之源.“-”表示两端的物质能反应,“→”表示物质间存在转化关系.(部分生成物和反应条件已略去)