题目内容
(2011年甘肃兰州,36题)现有一包只含氯化钙杂质的粗盐样品。某校化学兴趣小组的同学为测定该粗盐样品中氯化钙的质量分数,称取该食盐样品10g,充分溶解于100ml水中,(水的密度为1g/㎝3).在滴加适量的碳酸钠溶液,产生沉淀的质量与加入碳酸钠溶液的质量关系如下图所示。试计算:
(1)该粗盐样品中氯化钙的质量分数。
(2)过滤后所得滤液中溶质的质量分数。(精确到0.1%)。
(1)该粗盐样品中氯化钙的质量分数。
(2)过滤后所得滤液中溶质的质量分数。(精确到0.1%)。
(1)设生成2.0克碳酸钙沉淀需氯化钙的质量为x ,同时生成氯化钠的质量为y
Na2CO3+CaCl2=CaCO3↓+2NaCl
100 117
X 2.0g
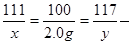
X="2.22g " y=2.34g
则粗盐中氯化钙的质量分数为: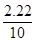 ⅹ100%=22.2%
ⅹ100%=22.2%
(2)过滤后所得滤液中溶质的质量为10g—2.22g+2.34g==10.12g
过滤后所得滤液中溶质的质量分数为10.12g÷100g+21.2g+10g-2.0g==7.8%
Na2CO3+CaCl2=CaCO3↓+2NaCl
100 117
X 2.0g
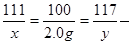
X="2.22g " y=2.34g
则粗盐中氯化钙的质量分数为:
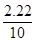 ⅹ100%=22.2%
ⅹ100%=22.2%(2)过滤后所得滤液中溶质的质量为10g—2.22g+2.34g==10.12g
过滤后所得滤液中溶质的质量分数为10.12g÷100g+21.2g+10g-2.0g==7.8%
略

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目