题目内容
【题目】铜是生活中常见的一种金属,在生活、生产中有广泛的应用。

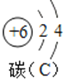
(1)如图为铜元素在元素周期表中的信息,铜元素的原子序数为___;
(2)铜离子(Cu2+)的核外电子数为____________;
(3)电气工业上常用铜作电缆的内芯,是利用铜具有良好的_____性;
(4)铜是一种不活泼的金属,但铜制品长期露置在潮湿空气中,表面变绿色,即生成了“铜绿”(化学式:Cu2(OH)2CO3)。
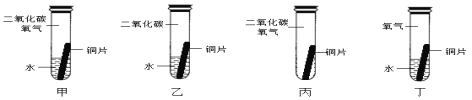
某同学根据铜绿的成分Cu2(OH)2CO3作出猜想:金属铜锈蚀的条件除有氧气和水外,还必须有二氧化碳。为证明“必须有二氧化碳”,需要进行如图所示实验中的_____(选填实验编号甲、乙、丙、丁)
(5)某兴趣小组以锈蚀严重的废铜屑为原料(假设不含其他杂质)制取纯铜。如图是兴趣小组设计的两种回收铜的实验方案:
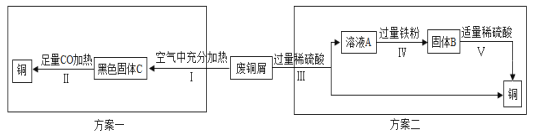
查阅资料:Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑
(分析评价)
①步骤Ⅲ、Ⅳ、Ⅴ都需要进行的实验操作是___________;
②步骤Ⅳ过程发生反应的化学方程式为__________________、_________________;
③同一份废铜屑分别通过上述两种方案最终得到的铜的质量:方案一_____(填“>”或“=”或“<”)方案二。以上两种方案中,方案二优越于方案一,理由是________(答一点)。
(拓展探究)在方案一中,小明和小丽分别取24克氧化铜,用CO还原,小明得到19.2克红色固体,小丽得到20.8克红色固体。为什么两人得到的红色固体质量不相等?
查阅资料:
Ⅰ.CO还原CuO时也可产生红色的氧化亚铜(Cu2O)
Ⅱ.Cu2O+H2SO4(稀)=Cu+CuSO4+H2O
他们分析推断:
④一致认为________(填“小明”或“小丽”)的产物中肯定含有Cu2O;
⑤用CO还原4克CuO得到红色固体a克,若红色固体为Cu和Cu2O的混合物,则a的取值范围为____________;
⑥可以用简单的实验验证红色固体中是否有Cu2O,请简述操作、现象及结论:_____。
(6)我国约在南北朝时就开始冶炼黄铜。黄铜是铜和锌的合金(Cu-Zn),它可用来制造电器零件及日用品。为了测定某黄铜样品中铜的质量分数(不考虑黄铜中的其他杂质),现将30g稀盐酸分三次加入到10g黄铜样品粉末中,每次充分反应后,测定本次生成氢气的质量,实验数据见表。试求:
第一次 | 第二次 | 第三次 | |
加入稀盐酸的质量(g) | 10 | 10 | 10 |
本次生成氢气的质量(g) | 0.04 | m | 0.02 |
①m=____________。
②此黄铜样品中铜的质量分数是多少_______?。
③稀盐酸的溶质质量分数是_______。
④在坐标系中画出生成氢气总质量与加入盐酸质量关系的图像。______
【答案】29 27 导电性 甲丁 过滤 Fe + H2SO4 ==== FeSO4 + H2 ↑ Fe +CuSO4 ==== FeSO4 +Cu = 不需要加热、操作简单(合理即可) 小丽 3.2g<a<3.6g 取样加入适量稀硫酸,溶液变成蓝色,则证明红色固体中含有Cu2O 0.04 67.5% 14.6% 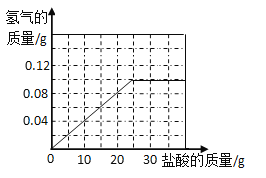
【解析】
(1)根据元素周期表中的信息知道,铜元素的原子序数为29;
(2)铜原子形成铜离子(Cu2+)时,失去了两个电子,所以铜离子(Cu2+)的核外电子数为29-2=27;
(3)电气工业上常用铜作电缆的内芯,是利用铜具有良好的导电性。
(4)做对比实验必须控制变量,其中一个实验中有铜、水、氧气、二氧化碳,该实验中铜锈蚀,另外一个实验中有铜、水、氧气,该实验中无二氧化碳,铜没有锈蚀,通过对比可知,二氧化碳是铜锈蚀的必要条件,故选甲、丁。
(5)分析评价:①通过过滤可将固体与液体分离,所以该实验操作是过滤。②溶液A中含有稀硫酸和硫酸铜溶液,加入过量铁粉,发生反应的化学方程式为:Fe+H2SO4==FeSO4+H2↑、Fe+CuSO4==Cu+FeSO4 。③反应前后各种元素的质量相等,所以两种实验方案反应后得到铜的质量相等。方案二不需要加热、操作简单,并且无污染。
拓展探究:④氧化亚铜中含有氧元素,会使固体质量偏大,故填“小丽”。⑤当CuO完全被还原为Cu时,设生成Cu的质量是x,
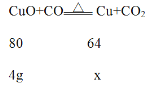
![]() =
=![]() ,解得x=3.2g
,解得x=3.2g
当CuO完全被还原为Cu2O时,设生成Cu的质量是y。
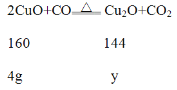
![]() =
=![]() ,解得y=3.6g
,解得y=3.6g
若红色固体为Cu和Cu2O的混合物,则a的取值范围为3.2g<a<3.6g
⑥Cu2O可与稀硫酸反应生成蓝色硫酸铜溶液,而铜与稀硫酸不反应,所以取样加入适量稀硫酸,如果溶液变成蓝色,则证明红色固体中含有Cu2O。
(6)第一次加入10g稀盐酸生成0.04g氢气,第三次加入10g稀盐酸生成0.02g氢气,说明第二次加入稀盐酸反应后有锌剩余,所以第二次加入10g稀盐酸生成0.04g氢气。①m=0.04。
②由实验数据可知,一共生成氢气的质量是0.04g+0.04g+0.02g=0.1g,设此黄铜样品中锌的质量是x。

![]() =
=![]() ,解得x=3.25g
,解得x=3.25g
此黄铜样品中铜的质量为:10g-3.25g=6.75g
此黄铜样品中铜的质量分数为:![]() ×100%=67.5%
×100%=67.5%
③由实验数据可知,10g稀盐酸与足量的锌反应生成0.04g氢气,设稀盐酸的溶质质量分数是z。

![]() =
=![]() ,解得z=14.6%
,解得z=14.6%
④当消耗10g稀盐酸时生成0.04g氢气,最多生成0.1g氢气,根据数据分析知道,此时消耗稀盐酸的质量是25g。然后将点连接起来,即可得到氢气总质量与加入盐酸质量关系的图像。

 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
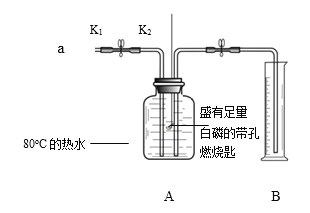
各地期末复习特训卷系列答案【题目】某化学兴趣小组在探究物质燃烧条件时,做了如下实验:
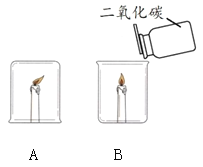
同学们发现两支蜡烛都熄灭了。
(提出问题)实验A中蜡烛熄灭的原因是什么?
(猜想与假设)
猜想1:烧杯内的氧气被耗尽,所以蜡烛熄灭。
猜想2:烧杯内的二氧化碳含量升高,所以蜡烛熄灭。
(进行实验)
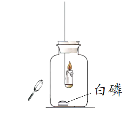
实验I:点燃蜡烛,塞紧胶塞。待蜡烛熄灭后,用放大镜照射白磷。观察到白磷燃烧。
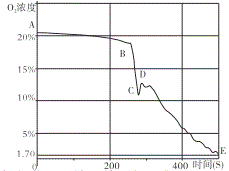
实验II:经检测,实验A中,蜡烛熄灭时,烧杯内二氧化碳的体积分数约为3%。在集气瓶中按照一定的体积比收集气体,分别放入燃烧的蜡烛和燃烧的红磷,实验记录如下:
V(O2):V(CO2) | 蜡烛 | 红磷 |
1:4 | 燃烧 | 燃烧 |
1:5 | 燃烧 | 燃烧 |
1:6 | 熄灭 | 燃烧 |
1:9 | 熄灭 | 燃烧 |
(解释与结论)
(1)实验B中蜡烛熄灭,体现二氧化碳的化学性质是_______。
(2)实验I的目的是_______。
(3)写出红磷燃烧的化学方程式_______。
(4)实验II证明猜想2错误,依据的实验现象是_______。
(5)结合实验I与实验II,得出的实验结论是_______。
(实验反思)
(6)通过此实验,同学们对物质燃烧的条件有了新的认识,如_______。