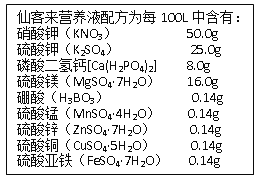
题目内容
【题目】某同学利用下图所示装置进行实验。已知:白磷的着火点是40℃
步骤I.检查装置的气密性。
步骤II.将盛有足量白磷的带孔燃烧匙伸入A瓶中,向瓶中加满80℃热水,塞紧瓶塞。
步骤III.打开K1、K2,从a口向瓶中鼓入空气,待瓶中的液面低于燃烧匙底部时,关闭K1、K2。此时量筒中水的体积为200mL。
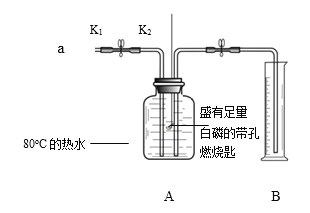
(1)步骤Ⅲ中,关闭K1、K2后观察到的现象是______,反应的化学方程式为______。
(2)对比步骤II和III可知,可燃物燃烧的条件之一是______。
(3)待装置冷却至室温后,打开K2,观察到______,说明空气中氧气的含量约占1/5。
【答案】 白磷燃烧,产生大量的白烟 4P+ 5O2 ![]() 2P2O5 与氧气接触 量筒B中的水倒流回A中约40mL,剩余液体体积约为160mL
2P2O5 与氧气接触 量筒B中的水倒流回A中约40mL,剩余液体体积约为160mL
【解析】(1).燃烧需要同时具备的三个条件:物质有可燃性、温度达可燃物的着火点、与氧气充分接触;当80度热水中白磷接触氧气时,白磷燃烧,产生大量白烟;反应的化学方程式为4P+ 5O2 点燃2P2O5,(2)对比步骤II没有通入空气时达到着火点的白磷不燃烧,和步骤III通入空气后达到着火点的白磷燃烧,可知,可燃物燃烧的条件之一是可燃物与氧气充分接触;(3)从a口向瓶中鼓入空气,待瓶中的液面低于燃烧匙底部时,关闭K1、K2。此时量筒中水的体积为200mL。由于压入量筒内水的体积等于进入瓶内空气的体积,可知,通入瓶中的空气共200ml;白磷燃烧后,待装置冷却至室温后,打开K2,观察到量筒B中的水倒流回A中约40mL,剩余液体体积约为160mL,倒流入瓶内的水的体积等于原瓶内空气中氧气的体积,所以200ml空气中有40ml氧气,说明空气中氧气的含量约占1/5。

【题目】高氯酸钾(KClO4)可用作火箭推进剂,其溶解度如下表,下列说法正确的是( )
温度/℃ | 20 | 40 | 60 | 80 |
溶解度/g | 1.68 | 3.73 | 7.3 | 13.4 |
A. 高氯酸钾的溶解度随温度升高而减小
B. 20℃时,将2g高氯酸钾溶于98g水可配制2%的溶液
C. 60℃时,高氯酸钾饱和溶液中溶质的质量分数是7.3%
D. 80℃的高氯酸钾饱和溶液冷却至40℃有晶体析出现象