题目内容
【题目】Na2CO3在工业和生活中有重要的作用。它的来源主要有以下两种途径:
I.将制碱与制氨结合起来的联合制碱法。这个方法是由我国的制碱工业先驱_发明的。
A 张青莲
B 道尔顿
C 侯德榜
D 华罗庚
Ⅱ.自然界有很多咸水湖,人们通过“冬天捞喊,夏天晒盐”的方式获得湖盐,其中就含有Na2CO3。
(1)小明同学想对某夏天制得的湖盐样品成分进行探究,查阅资料后他对样品成分做出了三种猜想。
猜想一:NaCl、Na2CO3
猜想二:NaCl、Na2SO4;
猜想三:NaCl、Na2CO3、Na2SO4请帮助他完成如下实验:
实验操作 | 实验现象 | 实验结论 | |
实验一 | 取少量样品于试管中,加适量水溶解后,加入过量稀HNO3 | 产生能使澄清石灰水变浑浊的气体 | 猜想___不成立 |
实验二 | 向实验一所得的溶液中加入适量的________ | __ | 猜想三成立 |
(2)小明同学为进一步确定上述湖盐样品中Na2CO3 的质量分数,取该湖盐样品10.0g做了如图所示的补充实验。(注:所用药品均足量)
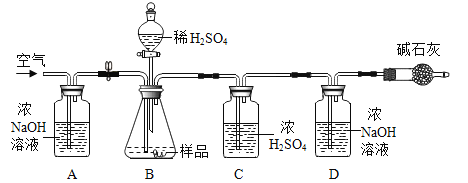
①反应结束之后打开止水夹并通入空气的目的是____。
②装置D中发生的反应为____(用化学方程式表示)。
③实验中碱石灰(含氧化钙和氢氧化钠)的作用是___。
④实验结束后,测得装置D增重0.33g,则该湖盐样品中Na2CO3的质量分数为多少___?
【答案】C 二 BaCl2溶液[或Ba( OH)2溶液或Ba(NO3)2溶液] 有白色沉淀生成 将装置B中产生的二氧化碳全部赶入装置D中 ![]() 防止空气中的二氧化碳进入装置D中,使测量结果更准确 7. 95%
防止空气中的二氧化碳进入装置D中,使测量结果更准确 7. 95%
【解析】
I、联合制碱法是由我国的制碱工业专家侯德榜发明的。故选C。
Ⅱ、(1)实验一:取少量样品于试管中,加适量水溶解后,加入过量稀HNO3,产生产生能使澄清石灰水变浑浊的气体,该气体是二氧化碳,则样品中含有碳酸钠,所以猜想二不成立。
实验二:该实验结论是猜想三成立,则样品中还含有硫酸钠,证明存在有硫酸根离子,那么要向实验一所得的溶液中加入适量的氯化钡溶液(或氢氧化钡、硝酸钡溶液),氯化钡与硫酸钠反应生成硫酸钡沉淀和氯化钠,观察到有白色沉淀生成。
(2)①反应结束之后,锥形瓶内还有二氧化碳末排出,所以打开止水夹并通入空气的目的是将装置B中产生的二氧化碳全部赶入装置D中,使生成的二氧化碳完全被氢氧化钠吸收。
②装置D中是氢氧化钠吸收二氧化碳生成碳酸钠和水,反应化学方程式为![]() 。
。
③实验中碱石灰的作用是防止空气中的二氧化碳进入装置D中,使测量结果更准确。
④解:设样品中碳酸钠的质量为X。
由题意可知,装置D增重0.33 g为生成二氧化碳的质量。
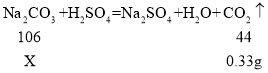
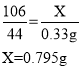
则该湖盐样品中Na2CO3的质量分数为![]() 。
。

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案【题目】某化学兴趣小组对“氧化铜能否作过氧化氢分解的催化剂”进行了如下探究:
(实验探究)
实验编号 | 实验操作 | 实验现象 | 实验分析或结论 | |
实验分析 | 实验结论 | |||
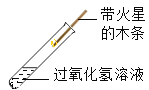
① |
| 有少量气泡产生,木条不复燃 | 过氧化氢能分解,但是______ | 氧化铜是过氧化氢分解的催化剂 |
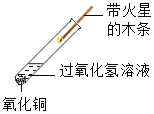
② |
| ________ | 氧化铜能加快过氧化氢的分解速率 | |
(1)写出实验②中发生的反应的化学方程式:___________________________________。
(交流反思)实验过程中加入两支试管中的过氧化氢溶液应满足的要求除了体积和温度相同之外,还要保证___________相同。
(2)小明同学认为仅由上述实验还不能完全得出表内的“结论”,他补充设计了以下两个探究实验。
实验一:称量反应后的固体质量,并与反应前的称量数据作比较,其目的是证明___________。
实验二:另取5 mL 5%的过氧化氢溶液于试管中,再向其中加入实验②反应后的固体剩余物,其余操作同实验②,其目的是证明___________;小明在进行实验时,发现试管内有许多水雾,由此推断过氧化氢分解是____(填“吸热”或“放热”)反应。
(实验拓展)小红同学用MnO2、CuO两种催化剂分别与海藻酸钠溶液混合,滴入氯化钙溶液制成含等质量催化剂、大小相同的海藻酸钠微球,探究分解过氧化氢溶液制取氧气的适宜催化剂。
实验操作:取30粒含MnO2的海藻酸钠微球,采用图1装置进行实验。然后改用等量含另一种催化剂的海藻酸钠微球,重复上述实验,得到图2的锥形瓶内压强随时间变化的曲线图。
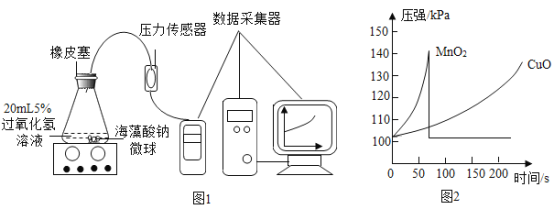
(3)每次实验时,海藻酸钠微球数应保持相同的原因是_________________________。
(4)用含MnO2的海藻酸钠微球进行实验,60s时压强瞬间回落,其原因是_________________________。
(5)从实验曲线看,催化效果较好、反应温和的催化剂是_________________________。