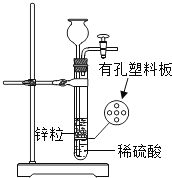
题目内容
【题目】2018年10月23日,举世瞩目的港珠澳大桥正式开通,其总用钢量接近100万吨!请根据所学金属的有关知识回答:
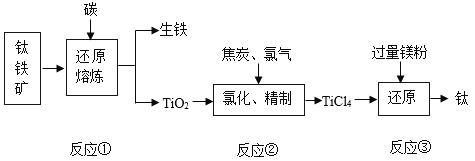
(1)以赤铁矿为例,写出工业炼铁的反应原理____ (用化学方程式表示)。
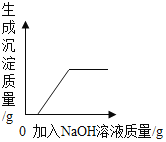
(2)向m克AgNO3、Cu(NO3)2和Fe(NO3)2的混合溶液中加入Zn,充分反应后过滤,所得滤液质量仍为m克,则滤渣中一定有什么物质____?并写出可能发生的反应的化学方程式____。
【答案】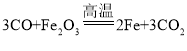 Ag、Cu
Ag、Cu ![]()
【解析】
(1)用赤铁矿为原料进行炼铁,反应原理是氧化铁和一氧化碳高温生成二氧碳和铁,化学方程式为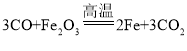 。
。
(2)向m克AgNO3、Cu(NO3)2和Fe(NO3)2的混合溶液中加入Zn,根据金属活动性顺序,锌能依次置换银、铜和铁,而充分反应后过滤,所得滤液质量仍为m克,根据质量守恒定律,反应前后溶液质量相等,则参加反应锌的质量一定等于生成金属固体的质量。锌先与硝酸银反应,方程式为![]() ,依据化学方程式,参加反应锌的质量与生成银的质量比为65:216,由此可知,生成金属银的质量大于参加反应锌的质量,所以锌还一定与硝酸铜反应,反应方程式为
,依据化学方程式,参加反应锌的质量与生成银的质量比为65:216,由此可知,生成金属银的质量大于参加反应锌的质量,所以锌还一定与硝酸铜反应,反应方程式为![]() ,依据化学方程式,参加反应的锌的质量与生成铜的质量比为65:64,由此可知,生成金属铜的质量小于参加反应锌的质量。如果参加反应锌的质量一定等于生成金属固体的质量。
,依据化学方程式,参加反应的锌的质量与生成铜的质量比为65:64,由此可知,生成金属铜的质量小于参加反应锌的质量。如果参加反应锌的质量一定等于生成金属固体的质量。
则滤渣中一定有银和铜;可能还有铁,所以可能发生反应的化学方程式为![]() 。
。

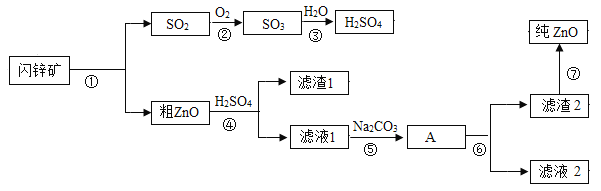
【题目】Na2CO3在工业和生活中有重要的作用。它的来源主要有以下两种途径:
I.将制碱与制氨结合起来的联合制碱法。这个方法是由我国的制碱工业先驱_发明的。
A 张青莲
B 道尔顿
C 侯德榜
D 华罗庚
Ⅱ.自然界有很多咸水湖,人们通过“冬天捞喊,夏天晒盐”的方式获得湖盐,其中就含有Na2CO3。
(1)小明同学想对某夏天制得的湖盐样品成分进行探究,查阅资料后他对样品成分做出了三种猜想。
猜想一:NaCl、Na2CO3
猜想二:NaCl、Na2SO4;
猜想三:NaCl、Na2CO3、Na2SO4请帮助他完成如下实验:
实验操作 | 实验现象 | 实验结论 | |
实验一 | 取少量样品于试管中,加适量水溶解后,加入过量稀HNO3 | 产生能使澄清石灰水变浑浊的气体 | 猜想___不成立 |
实验二 | 向实验一所得的溶液中加入适量的________ | __ | 猜想三成立 |
(2)小明同学为进一步确定上述湖盐样品中Na2CO3 的质量分数,取该湖盐样品10.0g做了如图所示的补充实验。(注:所用药品均足量)
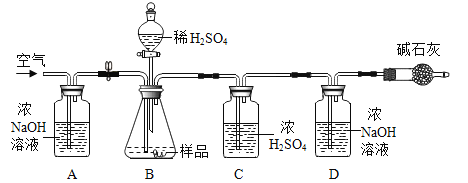
①反应结束之后打开止水夹并通入空气的目的是____。
②装置D中发生的反应为____(用化学方程式表示)。
③实验中碱石灰(含氧化钙和氢氧化钠)的作用是___。
④实验结束后,测得装置D增重0.33g,则该湖盐样品中Na2CO3的质量分数为多少___?