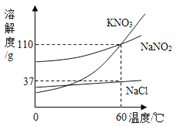
题目内容
【题目】红枣中含有丰富的VC和糖类,常食能增强人体的免疫力,有补血养气安神等良好功效,红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图1所示。某化学兴趣小组对一包久置的“504双吸剂”固体样品产生了浓厚的兴趣,设计实验进行探究。

[提出问题]久置固体的成分是什么?
[作出猜想]久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3。
[查阅资料]铁与氯化铁溶液在常温下发生反应生成氯化亚铁。
[实验探究]甲同学的方案:
实验操作 | 实验现象 | 实验结论 |
取少量固体于试管中, 滴加足量的______________。 | 固体逐渐消失, 有大量无色气体产生,得到浅绿色溶液。 | 固体中一定含有___________,一定不含Fe2O3 |
乙同学认为甲同学的实验并不能得出一定不含Fe2O3 的结论,理由是____________________________。
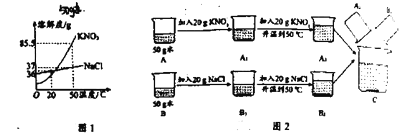
他设计如图2实验方案继续验证。
(1)步骤①样品用磁铁吸引前需经过研碎,其中研碎的目的是__________________。
(2)②中固体溶解时放出大量热,由此可以判断固体中一定含有__________________。
(3)③中反应的化学方程式是__________________。
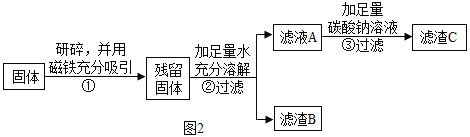
乙同学对滤渣B又进行了探究。
实验操作 | 实验现象 | 实验结论 |
取少量固体于试管中,滴加足量的稀盐酸,并将气体通人澄清石灰水 | 固体逐渐消失,有气泡产生,_________________。 | 固体中一定含有CaCO3和Fe2O3 |
[反思与评价]甲、乙两同学经过讨论后,完善实验方案最终确定该久置固体的成分是Fe、Fe2O3、CaO、CaCO3。
【答案】稀盐酸 Fe 若含有三氧化二铁,三氧化二铁与稀盐酸反应生成氯化铁和水,氯化铁与铁反应生成氯化亚铁,氯化亚铁溶液呈浅绿色,因此仅仅通过最后溶液中含有氯化亚铁不能确定只含有铁,而不含有三氧化二铁 增大接触面积利于磁铁吸收将铁与其他成分分离,也有利于加水使物质溶解 CaO ![]() 该气体使澄清石灰水变浑浊,试管内溶液呈黄色
该气体使澄清石灰水变浑浊,试管内溶液呈黄色
【解析】
化学兴趣小组设计实验进行探究久置的“504双吸剂”固体样品的成分。结合标签图可知,铁粉与氧气水反应生成铁锈,铁锈的主要成分为三氧化二铁,生石灰是氧化钙,氧化钙与水反应生成氢氧化钙,氢氧化钙与二氧化碳反应生成碳酸钙和水,则有:
提出问题:久置固体的成分是什么?
作出猜想:久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3。
结合相关资料信息和实验验方案,则有:
实验探究:
甲同学的方案
实验操作:取少量固体于试管中, 滴加足量的稀盐酸
实验现象:固体逐渐消失,有大量无色气体产生,得到浅绿色溶液
实验结论:固体中一定含有Fe,一定不含Fe2O3
乙同学认为甲同学的实验并不能得出一定不含Fe2O3的结论,理由是若含有三氧化二铁,三氧化二铁与稀盐酸反应生成氯化铁和水,氯化铁与铁反应生成氯化亚铁,氯化亚铁溶液呈浅绿色,因此仅仅通过最后溶液中含有氯化亚铁不能确定只含有铁,而不含有三氧化二铁。
结合如图2实验方案流程图,则有:
(1)步骤①样品用磁铁吸引前需经过研碎,其中研碎的目的是增大接触面积利于磁铁吸收将铁与其他成分分离,也有利于加水使物质溶解。
(2) CaO、Ca(OH)2和CaCO3三种物质,氧化钙与水反应放出大量的热,②中固体溶解时放出大量热,由此可以判断固体中一定含有CaO。
(3)③中加入碳酸钠溶液生成固体,发生的反应是氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式是![]() 。
。
乙同学对滤渣B又进行了探究,结合实验操作和实验结论可推测实验现象
实验操作:取少量固体于试管中,滴加足量的稀盐酸,并将气体通人澄清石灰水
实验现象:固体逐渐消失,有气泡产生,该气体使澄清石灰水变浑浊,试管内溶液呈黄色
实验结论:固体中一定含有CaCO3和Fe2O3
反思与评价:
甲、乙两同学经过讨论后,完善实验方案最终确定该久置固体的成分是Fe、Fe2O3、CaO、CaCO3。

【题目】氢氧化钠是一种重要的化工原料,但在空气中很容易变质。
(1)在实验室开放日活动中,某化学兴趣小组探究一瓶氢氧化钠溶液是否变质,进行以下探究:
①氢氧化钠溶液变质的原因是_____(用化学方程式表示)。
②小建取适量样品于试管中,向其中滴加几滴酚酞溶液,观察到溶液变红色,由此判断这瓶氢氧化钠溶液未变质。你认为小建的结论是否成立?_____(选填“成立”或“不成立”),理由是_____。
③小齐取适量样品于试管中,向其中加入足量的稀盐酸,观察到的现象是_____,说明这瓶氢氧化钠溶液已变质。
④为进一步探究该瓶氢氧化钠溶液是部分变质还是全部变质,小思设计了以下实验方案:
操作步骤 | 实验现象 | 结论 |
a.取适量样品溶液于试管中,滴加足量的氯化钡溶液,过滤 | _____ | _____ |
b.向滤液中滴加适量_____溶液 | 溶液变红 |
(2)实验室用50 g溶质质量分数为18. 25%的稀盐酸与足量碳酸钙反应制取二氧化碳。请计算可制得二氧化碳的质量_____。
【题目】实验室某混合溶液由硫酸和硫酸铜溶液组成。探究小组同学进行了如下实验:取124.5g该混合溶液于烧杯中,然后将120gNaOH溶液分六次加入其中,每次充分反应后称量所得溶液及沉淀的质量,所测数据如下表所示。
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | 第6次 | |
加入NaOH溶液的质量/g | 20 | 20 | 20 | 20 | 20 | 20 |
反应后溶液的质量/g | 144.5 | 164.5 | 179.6 | 189.8 | 200 | 220 |
每次产生沉淀的质量/g | 0 | 0 | m | n | 9.8 | 0 |
计算:(1)上述表格中产生沉淀的质量:m=_____,n=_____
(2)所加NaOH溶液中溶质的质量分数。_____
(3)第5次加入NaOH溶液充分反应后所得溶液中溶质的质量分数。_____