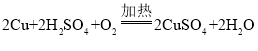题目内容
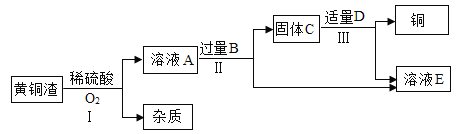
【题目】某班同学取用相同总质量的木炭粉和氧化铜的混合物,按图示装置进行实验。实验过程中发现有的小组“黑色固体变红色”这一实验现象不明显。小组同学对此异常现象进行如下探究。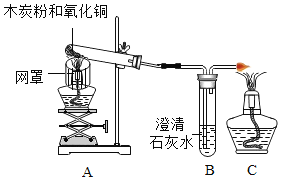
(知识回忆)碳和氧化铜反应的化学方程式为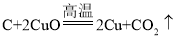 ,理论上碳和氧化铜的质量比为_____。
,理论上碳和氧化铜的质量比为_____。
(作出猜想)产生异常现象可能与所取用木炭粉和氧化铜的质量比有关。
(实验探究)小组同学用总质量相同但质量比不同的木炭粉和氧化铜的混合物(不考虑其中杂质),分别进行实验,部分实验现象记录如下:
实验序号1 | m(C):m(CuO) | 实验后A处试管中固体颜色 | C处导管口的现象 |
1 | 1:8 | 红色固体中有少量黑色固体 | 尾气燃烧 |
2 | 1:9 | 红色固体中有较少量黑色固体 | 尾气燃烧 |
3 | 1:10 | 红色固体中有很少量黑色固体 | 尾气不燃烧 |
4 | 1:11 | 红色固体中有极少量黑色固体 | _____ |
5 | 1:12 | 红色固体中无黑色固体 | 尾气不燃烧 |
6 | 1:13 | 红色固体中有较多黑色固体 | 尾气不燃烧 |
(交流讨论)
(1)推测实验4中“C处导管口的现象”是_____。
(2)上述探究可得出,实验时所用木炭粉和氧化铜的质量比控制在1:10~1:12之间,可观察到黑色固体明显变红,同时还可减少_____(填化学式)排放,防止空气污染。
(3)检验实验6反应后A处试管中黑色固体物质,可滴加的试剂是_____,观察到的现象是_____。
(反思评价)分析发现,实验5
【答案】3:40 不燃烧 CO 稀盐酸 黑色固体溶解,溶液呈蓝色 C+CO2![]() 2CO
2CO
【解析】
[知识回忆]碳和氧化铜反应 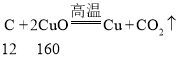 ,故理论上碳和氧化铜的质量比为12:160=3:40,故填:3:40。
,故理论上碳和氧化铜的质量比为12:160=3:40,故填:3:40。
[交流讨论]
(1)木炭粉和氧化铜反应,刚开始木炭过量,生成的二氧化碳和碳高温生成一氧化碳,所以尾气能被点燃,随着碳粉减少生成的一氧化碳逐渐减少,实验3生成尾气不能被点燃,实验4碳粉更少一氧化碳更少,也不能被点燃,故填:不燃烧。
(2)实验时所用木炭粉和氧化铜的质量比控制在1:10~1:12之间,可观察到黑色固体明显变红,同时还可减少CO,防止污染空气,故填:CO。
(3)实验5有红色固体无黑色固体,说明恰好完全反应,实验6碳粉减少氧化铜会有剩余,反应后A处试管中黑色固体物质是剩余的氧化铜,氧化铜与盐酸反应生成氯化铜和水,可滴加的试剂是稀盐酸,现象是黑色固体溶解,溶液呈蓝色,故填:黑色固体溶解,溶液呈蓝色。
(4)实验5中m(C):m(CuO)比值与理论值不符,实验后却无黑色固体残留,是因为碳粉和二氧化碳发生了反应生成了一氧化碳,化学方程式C+CO2![]() 2CO ,故填:C+CO2
2CO ,故填:C+CO2![]() 2CO。
2CO。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案