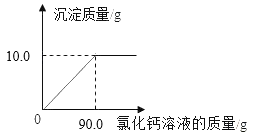
题目内容
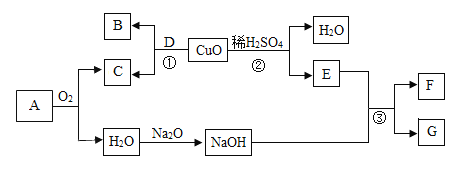
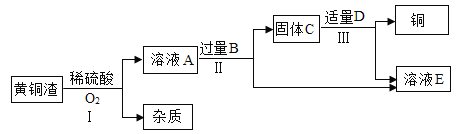
【题目】工业上处理黄铜渣(Cu、Zn、ZnO、CuO和杂质)废料时,通常将其转化为硫酸锌和铜等有价产品。其主要流程如图所示(杂质不溶于水也不参与反应):
资料: ;
;![]() ;
;![]()
(1)物质B的化学式是___。
(2)过程Ⅱ中分离操作的名称是______,该操作用到的玻璃仪器有烧杯、玻璃棒和___(填仪器名称)。
(3)过程Ⅲ中有气体产生,该反应的化学方程式是____。
【答案】Zn 过滤 漏斗 ![]()
【解析】
黄铜渣经过过程Ⅰ去除杂质后留下硫酸锌和硫酸铜溶液,溶液加入过量B后,生成最终产品溶液E,硫酸锌,因此B为锌;固体C中存留剩下的B(锌)和铜,加入适量的D生成最终产品溶液E,因此D是硫酸,发生的反应是![]() 。
。
(1)B为金属锌,化学式为Zn;
(2)过程Ⅱ用于分离固体和液体,因此其操作名称是过滤;过滤操作用到的玻璃仪器有烧杯、玻璃棒和漏洞,因此此处填漏斗。
(3)过程Ⅲ中是D(硫酸)与金属锌反应其化学方程式为![]()

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案【题目】某化学兴趣小组的同学,为了比较金属 R 与铁、铜的金属活动性强弱,进行如下探究活动:
(査阅资料)铁的活动性比铜强。
(进行猜想)对三种金属的活动性顺序做出如下猜想: 猜想一:R>Fe>Cu;猜想二:_______________; 猜想三:Fe>Cu>R。
(收集证据)为了验证哪一种猜想成立,甲、乙、丙三位同学分别展开实验探究。
主要操作 | 主要现象 | 实验结论 | ||
甲 | 将打磨好的R 丝插入盛有硫酸铜溶液的试管中 | ____________ | 猜想一正确 | |
乙 | 将粗细相同打磨好的 R 丝、铁丝,分别插入体积和溶质质量分数都相同的稀盐酸中 | R 丝表面产生气泡速率比铁丝表面产生气泡速率_____________( 填 “快”或“慢”) | ||
丙 | 将粗细相同打磨好的 R 丝、铁丝,分别在空气中点燃 | R 丝在空气中剧烈燃烧,铁丝在空气中_______________ | ||
写出铁丝在氧气中燃烧的化学方程式:________________。
(交流反思)三位同学交流讨论后认为,比较金属活动性强弱的方法有多种。
(归纳总结)他们总结得出比较金属活动性强弱的常见方法有:
(1)金属与氧气反应的难易和剧烈程度;
(2)金属与酸溶液是否反应或反应的剧烈程度;
(3)金属与______________是否反应。
【题目】某班同学取用相同总质量的木炭粉和氧化铜的混合物,按图示装置进行实验。实验过程中发现有的小组“黑色固体变红色”这一实验现象不明显。小组同学对此异常现象进行如下探究。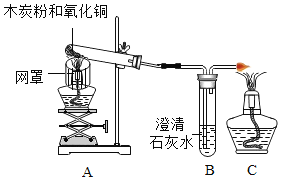
(知识回忆)碳和氧化铜反应的化学方程式为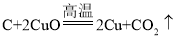 ,理论上碳和氧化铜的质量比为_____。
,理论上碳和氧化铜的质量比为_____。
(作出猜想)产生异常现象可能与所取用木炭粉和氧化铜的质量比有关。
(实验探究)小组同学用总质量相同但质量比不同的木炭粉和氧化铜的混合物(不考虑其中杂质),分别进行实验,部分实验现象记录如下:
实验序号1 | m(C):m(CuO) | 实验后A处试管中固体颜色 | C处导管口的现象 |
1 | 1:8 | 红色固体中有少量黑色固体 | 尾气燃烧 |
2 | 1:9 | 红色固体中有较少量黑色固体 | 尾气燃烧 |
3 | 1:10 | 红色固体中有很少量黑色固体 | 尾气不燃烧 |
4 | 1:11 | 红色固体中有极少量黑色固体 | _____ |
5 | 1:12 | 红色固体中无黑色固体 | 尾气不燃烧 |
6 | 1:13 | 红色固体中有较多黑色固体 | 尾气不燃烧 |
(交流讨论)
(1)推测实验4中“C处导管口的现象”是_____。
(2)上述探究可得出,实验时所用木炭粉和氧化铜的质量比控制在1:10~1:12之间,可观察到黑色固体明显变红,同时还可减少_____(填化学式)排放,防止空气污染。
(3)检验实验6反应后A处试管中黑色固体物质,可滴加的试剂是_____,观察到的现象是_____。
(反思评价)分析发现,实验5
【题目】某学校九年级学生小明在化学实验室清点化学药品时发现一包粉末状固体,这包粉末状固体可能由碳酸钠、氯化钠、氢氧化钡、硫酸钠、硝酸铜中的一种或几种组成。为了检验其成分,小明做了如下实验:
(1)取少量粉末状固体于烧杯中,加入足量的水,充分搅拌,静置,发现烧杯底部有白色未溶固体A和上层无色清液B。小明根据上述现象确定粉末状固体中一定不含有的物质是_____(填物质的化学式)。
(2)进一步探究固体A的成分
(提出问题)固体A的成分是什么?
(猜想与假设)I:BaCO3
Ⅱ:_____
III:BaSO4
(实验与探究)
实验步骤 | 实验现象 | 实验结论 | 相关化学方程式 |
取少量固体A于试管中,滴加过量的_____ | _____ | 猜想Ⅱ正确 | _____ |
根据上述实验结论,可以确定粉末状固体中一定含有_____。