��Ŀ����
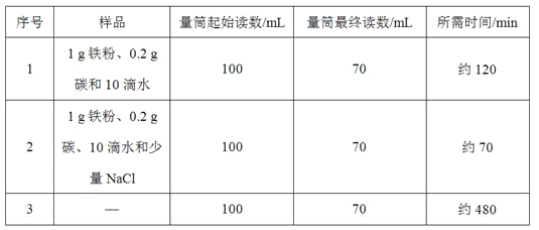
����Ŀ��ʵ���ҳ������������ķ�ˮ���ٶ���ˮ��ֻ�������ᣩ���辭���������ԣ�ij��ȤС��ͬѧ����һ����������������������Һ���������Է�ˮ��
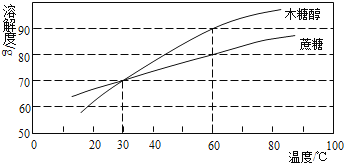
��1�����Լ���ˮ������ˮ�����Եķ�����_____��
��2������200g��������Ϊ4%������������Һ��
������m��NaOH����_____g��V��H2O��_____mL��ˮ���ܶȽ���Ϊ1.0gmL��1����
����ȡ�������ƣ�����������ƽƽ���һֻ�ձ�����������ƽ�����̣�����������Ȼ��_____���������Ⱥ�˳������ĸ����ֱ����ƽƽ�⡣
A ���ձ��м��������ƹ���
B ����Ҫ�������롢�ƶ�����
����ȡˮ�����ܽ⣻��ת�ơ�
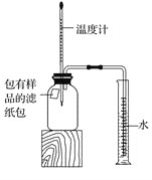
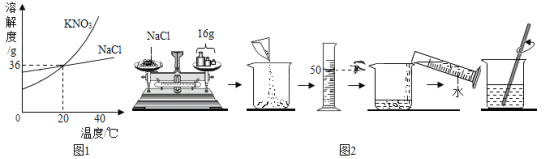
��3����������ˮ������������Һ�����ᷢ����Ӧ����û��ʵ��������ȤС��ͬѧ�������ͼ��ʾʵ�飺
����ƿ�м���10g������2�������Ƶ�����������Һ�����뼸�η�̪��Һ���õζ��ܣ��ζ���Ϊһϸ���Ĺ�״������һ�˾��л�˨���أ����Ͼ��п̶�ָʾ���ȣ����������ˮ��������������Һ��ɫǡ�ñ�Ϊ��ɫΪֹ����ش�
����̪��Һ��������_____��
���ߵμӷ�ˮ���߲�����Ŀ����_____��
�����ζ����з�ˮ����Ϊ20mLʱ����ƿ��Һ��һ�����ڵ���������_____�������ӷ��ţ���
����b����Һ��ɫǡ�ñ�Ϊ��ɫʱ������ȥ�˷�ˮ10mL������ȤС����������Է�ˮ���������������������Ҫ�õ����������⣬����Ϊ����Ҫ��������_____��
��4����ȤС��ͬѧ�ڵμӷ�ˮһ��ʱ�������Һ�����������ݲ�������һ���쳣�����������ǵ�̽�����������Ŀ���ԭ����_____�����û�ѧ����ʽ��ʾ����ʵ�ԭ��_____����Ҫ��ȥ��Һ�б������ɵ����ʣ����Ҫд�����ʵ�鷽����_____��
���𰸡�ȡ������Һ���Թ��У��μ�ʯ����Һ��ʯ����Һ���ɫ��˵����Һ������ 8 192 B��A �ж��Ƿ�ǡ����ȫ��Ӧ ʹ��Ӧ���ַ�Ӧ Na+ ��ˮ�ܶ� �������ƺͶ�����̼��Ӧ������̼���ƺ�ˮ 2NaOH+CO2�TNa2CO3+H2O ���ˮ�м�������������Һ��ֱ������������ʱΪֹ������
��������
����������Һ�Լ��ԣ���ʹ��̪��Һ���ɫ���ܺͶ�����̼��Ӧ����̼���ƺ�ˮ���ܺ�ϡ���ᷴӦ���������ƺ�ˮ��
̼���ƺ��������Ʒ�Ӧ����̼��Ƴ������������ơ�
��1������ˮ�����Եķ����ǣ�ȡ������Һ���Թ��У��μ�ʯ����Һ��ʯ����Һ���ɫ��˵����Һ�����ԣ�
��2���ټ���m��NaOH����200g��4%��8g��V��H2O����200g��8g����1.0gmL��1��192mL��
�ڳ�ȡ�������ƣ�����������ƽƽ���һֻ�ձ�����������ƽ�����̣�����������Ȼ����Ҫ�������롢�ƶ����룬���ձ��м��������ƹ��壬ֱ����ƽƽ�⣻
��3���ٷ�̪��Һ���������ж��Ƿ�ǡ����ȫ��Ӧ����ǡ����ȫ��Ӧʱ��Һ�ɺ�ɫ�����ɫ��
�ڱߵμӷ�ˮ���߲�����Ŀ����ʹ��Ӧ���ַ�Ӧ��ʵ������ȷ��
�۵��ζ����з�ˮ����Ϊ20mLʱ������������ȫ��Ӧ�����ж�ϡ�����Ƿ�ǡ����ȫ��Ӧ�������ƿ��Һ��һ�����ڵ���������Na+��
�ܵ�b����Һ��ɫǡ�ñ�Ϊ��ɫʱ������ȥ�˷�ˮ10mL������ȤС����������Է�ˮ���������������������Ҫ�õ����������⣬����Ϊ����Ҫ�������Ƿ�ˮ�ܶȣ�������Ϊ���ݷ�ˮ�ܶȺ�������Լ����ˮ���������ݷ�Ӧ�Ļ�ѧ����ʽ�����������Ƶ��������Լ���������������һ�����Լ������Է�ˮ�����������������
��4����ȤС��ͬѧ�ڵμӷ�ˮһ��ʱ�������Һ�����������ݲ��������Ŀ���ԭ���ǣ��������ƺͶ�����̼��Ӧ������̼���ƺ�ˮ����Ӧ�Ļ�ѧ����ʽ��2NaOH+CO2�TNa2CO3+H2O��
��Ҫ��ȥ��Һ�б������ɵ����ʣ�ʵ�鷽�������ˮ�м�������������Һ��ֱ������������ʱΪֹ�����˵õ�����������Һ��

 ���Ž�������С״Ԫϵ�д�
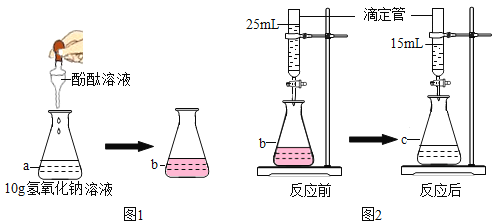
���Ž�������С״Ԫϵ�д�����Ŀ��ij��ѧ��ȤС���ͬѧ��̽���������й�����ʱ����������ͼ��ʾʵ�飺��Aʵ���������֧�Թ��ڵ����ʵ���һ�ྻ�ձ��У�һ��ʱ�����ˡ�Ϊȷ�����˺�õ�����������Һ�ijɷ֣�ͬѧ�ǽ���������ʵ�顣

ʵ��һ�������ijɷ���ʲô��
��1����ͬѧȡ�����������Թ��У�����ϡ���ᣬ�����ݲ�����֤�������ﲻ��_____����ͬѧͨ����������Ҳ�õ���ͬ���Ľ��ۣ����������������_____��
ʵ�������Һ�����������Щ��
��2��ͬѧ����Ϊһ��������������Ϊȷ�����ܺ��е��������ʣ�ͬѧ�ǽ���������ʵ�飺
ʵ�鲽�� | ʵ������ | ʵ����� |
ȡ������Һ�������м����������� | _____ | ��Һ������ʻ������������ͭ |
��д����������ͭ��Ӧ�Ļ�ѧ����ʽ��_____��
��3����ͬѧ�������ֱ�ӹ۲���Һ����ɫ�ж���Һ���Ƿ�������ͭ��ͬѧ�Ƕ�����ͭ��ҺΪʲô����ɫ�ܸ���Ȥ������̽������ͭ��Һ����������ʹ��Һ����ɫ����Ƶ�ʵ�鷽�����£�
ʵ����� | ʵ������ | ʵ����� |
��ȡ����_____��Һ���۲���ɫ | ��Һ����ɫ | ��������Ӳ���ʹ��Һ����ɫ |
��ȡ��������ͭ��Һ���۲���ɫ | ��Һ����ɫ | ͭ����ʹ��Һ����ɫ |
��4�����ˣ�3����ʵ�鷽���⣬�㻹�������������̽������ͭ��Һ�е�������������ʹ��Һ����ɫ��ʵ�������ҩƷ��������ѡ�������ʵ�������ʵ������
ʵ������ | ʵ������ |
_____ | _____ |
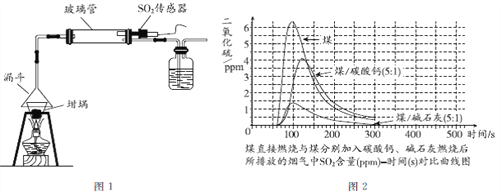
����Ŀ��1kg��ͬȼ��ȼ�ղ���CO2��SO2�����������ʾ��
ȼ�� | ȼ�ղ�������/g | |
CO2 | SO2 | |
���� | 2900 | 5.0 |
��Ȼ�� | 2500 | 0.1 |
ú | 2500 | 11.0 |
�����н�����ȼ����______��ʹ��______��ȼ��ʱ�����γ����ꡣ
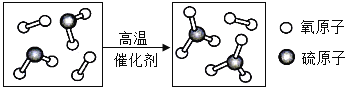
�������γɹ�����ijһ����Ӧ����ʾ��ͼ����ͼ��ʾ����÷�Ӧ�Ļ�ѧ����ʽΪ______��