题目内容
【题目】如图1是氯化钠和硝酸钾的溶解度曲线。分析并回答问题。
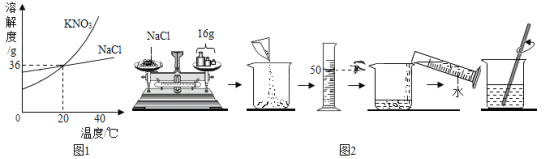
(1)影响固体物质溶解度的因素有温度和_________________。
(2)60℃时,从含有少量NaCl的饱和KNO3溶液中得到KNO3的方法是___________________。
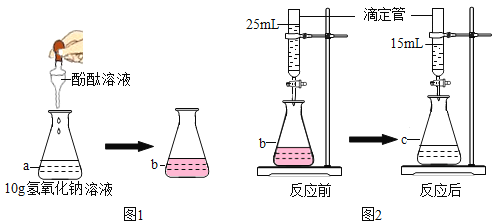
(3)甲同学按图2操作配制20℃时一定质量的NaCl饱和溶液(ρ水=1.0g/mL)。
①最后一步操作中用玻璃棒搅拌的目的是_____________________________。
②乙同学认为甲所配制的溶液是不饱和溶液,理由是______________________________。
【答案】溶质与溶剂的性质 降温结晶 加快NaCl的溶解 由溶解度曲线可知,20℃时,50g水中最多溶解NaCl的质量为18g,而甲在50g水中加入了16g NaCl
【解析】
(1)影响固体物质溶解度的因素有温度和溶质与溶剂的性质;
(2)60℃时,从含有少量NaCl的饱和KNO3溶液中得到KNO3的方法是降温结晶,因为硝酸钾的溶解度随温度的升高变化比氯化钠大;
(3)①玻璃棒搅拌的目的是:加快NaCl的溶解;②乙同学认为甲所配制的溶液是不饱和溶液,理由是:由溶解度曲线可知,20℃时,氯化钠的溶解度是36g,因此50g水中最多溶解NaCl的质量为18g,而甲在天平上称量了16 gNaCl,即在50g水中加入了16gNaCl。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案【题目】以硫酸镁与氯化钾为原料制备K2SO4的流程如下。
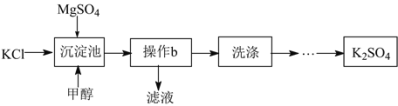
已知:20℃各物质的溶解度如表。
物质 | MgSO4 | MgCl2 | K2SO4 | KCl |
溶解度/g | 33.7 | 54.6 | 11.1 | 34.2 |
(1)沉淀池中相关物质的溶解度如表所示,写出沉淀池中发生的复分解反应的化学方程式_____,反应能在常温下发生的原因是_____。
(2)沉淀池中加入甲醇的目的是_____。
(3)操作b的名称是_____。进行操作b需要的玻璃仪器有烧杯、_____、_____、
(4)检验沉淀是否洗涤完全的试剂是_____。(填序号)
a氢氧化钠溶液 b氯化钠溶液 c稀硫酸