��Ŀ����
����Ŀ�����л�ѧ��������������A-G�����������������Ԫ�ص��������±���
���ʷ��� | ���� | ������ | ||
Ԫ������ | ���� | �ǽ��� | ���� | ���� |
���ʴ��� | A��B | C��D | E��F | G |
����A��B������C��Ӧ��A��C��Ӧ����������������Ԫ�ص���������3�U2��B��C��Ӧ�����������Ԫ����E��ͬ��C��D��Ӧ�������ﳣ����ΪҺ̬�������Ԫ����F��ͬ��A��B������G��Һ��Ӧ���ҷ�Ӧ��������Һ�����������ӡ���ش�
��1��C��һ����;��________��E�Ļ�ѧʽ��________��F������Ԫ����________��
��2��д����Ӧ�Ļ�ѧ����ʽ���� B+C________���� C+D________���� A+G________��
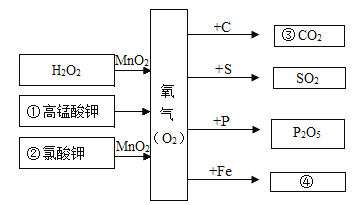
���𰸡��������������֡�֧��ȼ�յȣ���Fe2O3���������3 Fe + 2 O2![]() Fe3O4��2H2 + O2
Fe3O4��2H2 + O2 ![]() 2H2O��Mg + H2SO4 = MgSO4 + H2��
2H2O��Mg + H2SO4 = MgSO4 + H2��
��������
����A-G�dz��л�ѧ�������������ʣ������������֪����������A��B������ǽ�������C��Ӧ�������ѧ֪ʶ���Ʋ�CΪO2��������A��C��Ӧ����������������Ԫ�ص���������3��2=24��16���ʿ��Ʋ�AΪ����Mg�����ڷǽ�������C��O2����ǽ�������D��Ӧ���������ڳ�����ΪҺ̬�����Ʋ���������ӦΪH2O������Ʋ�DΪH2������ΪC��D��Ӧ������������Ԫ����F��ͬ���ʿ�֪FΪH2O2����������B��ǽ�������C��O2����Ӧ������������Ԫ����E����������Ԫ�أ���ͬ��˵������������E��Ϊͬ�ֽ�������������������ij�������ӦΪFe3O4��Fe2O3������Ʋ��������BΪFe������A��Mg����B��Fe��������G��Һ��Ӧ��˵��GӦΪϡ����Mg��Fe�����õĽ���������Һ������Ϊ���Ƿ�Ӧ��������Һ�����������ӣ���֪GӦΪϡ�ᣬ����G��������Ԫ����ɣ����Ʋ���Ϊϡ���ᣬ�������Ʋ����ԭ����֤����ȷ��
��1��C��һ����;�ǹ������������֡�֧��ȼ�յȣ���E�Ļ�ѧʽ��Fe2O3��F������Ԫ�������������2��д����Ӧ�Ļ�ѧ����ʽ���� B+C��3 Fe + 2 O2![]() Fe3O4���� C+D��2H2 + O2
Fe3O4���� C+D��2H2 + O2 ![]() 2H2O���� A+G��Mg + H2SO4 = MgSO4 + H2����
2H2O���� A+G��Mg + H2SO4 = MgSO4 + H2����

����Ŀ������ﮣ�Li2SO4����������ڲ�ͬ�¶�ʱ���ܽ�����±���
�¶�/�� | 0 | 10 | 20 | 30 | 40 | |
�ܽ� ��/g | Li2SO4 | 36.1 | 35.4 | 34.8 | 34.3 | 33.9 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | |
��ش��������⣺

��1�������ܽ�ȱ��������ܽ��������ͼ��ʾ�������ܱ�ʾLi2SO4�ܽ�����ߵ���_______����ס����ҡ�����
��2��Li2SO4��KNO3��ijһ�¶�ʱ������ͬ���ܽ��x����x�ķ�Χ��_________________��
��3��40��ʱ���к�����Li2SO4��KNO3������Һ���������ᴿKNO3���壬������________________��
��4����10��ʱ�������ʵı�����Һ�ֱ�������30�棬����Li2SO4��Һ�����ʵ���������__________���������������������KNO3��Һ�����ʵ�����������
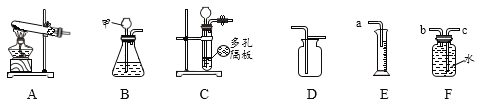
��5����ͼ��ʾ��20��ʱ����ʢ�б���Li2SO4��Һ���Թܷ���ʢˮ���ձ��У����ձ���ˮ�м���ij���ʺ��Թ����о������������������ʿ�����______������ĸ��ţ���
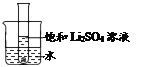
��Ũ���� �ڱ��� ����ʯ�ҹ��� ������粒��� ���������ƹ���
A���ڢ� B���٢ۢ� C���ۢ� D���٢ڢ�