题目内容
(丰台25)一定质量的稀硫酸和氢氧化钠溶液恰好完全反应,所得溶液中溶质质量分数为10%,则溶液中钠离子和水分子的个数比为
| A.1﹕71 | B.2﹕71 | C.1﹕79 | D.2﹕79 |
B
硫酸和氢氧化钠生成硫酸钠和水,假设硫酸钠溶液的质量为100克,则根据题意“溶液中溶质质量分数为10%”,可求知溶质的质量为:10克,则硫酸钠的物质的量为10/142 =5/71摩尔,水的物质的量为(100-10)÷18=5摩尔,因为该溶液中钠离子和水分子的个数比即为:2倍的硫酸钠的物质的量与水的物质的量的比.则:2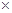 5/71:5=2:71.
5/71:5=2:71.
故选B.
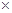 5/71:5=2:71.
5/71:5=2:71.故选B.

练习册系列答案
 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
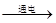 Cu2O+H2↑。若用此方法生产72kg的氧化亚铜,则参与电解的水的质量是多少?
Cu2O+H2↑。若用此方法生产72kg的氧化亚铜,则参与电解的水的质量是多少?