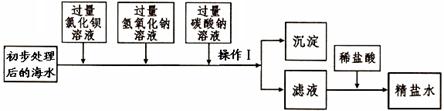
题目内容
(6分)为测定铜锌合金的组成,某化学小组的同学将200克稀硫酸分四次加入到40克合金中,得出如下数据和图像。请计算:
小题1:a的数值为 。
小题2:合金中铜的质量分数为 。
小题3:计算实验所用稀硫酸的质量分数(写出计算过程)。
小题1:a的数值为 。
小题2:合金中铜的质量分数为 。
小题3:计算实验所用稀硫酸的质量分数(写出计算过程)。
小题1:a=27
小题2:51.25%
小题3:19.6%
小题1:第一次加入50克硫酸时,固体溶解了40-33.5=6.5克,所以第二次再加入50克硫酸时,固体也会溶解6.5克,故a的值为33.5-6.5="27."
小题2:最终固体质量不变了,说明这20.5克固体,就是铜,因为铜不与硫酸反应,所以铜的质量分数为20.5/40=51.25%。
小题3:可以根据50克硫酸溶解了6.5克锌来计算。
设50克硫酸中溶质为X,
Zn+ H2SO4=" Zn" SO4+H2↑
65 98
6.5g X
65 / 98="6.5g" / X,
解得X=9.8克,
故所用稀硫酸的质量分数为9.8克/50克=19.6%

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

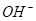 的数量有关;一定体积的溶液中
的数量有关;一定体积的溶液中