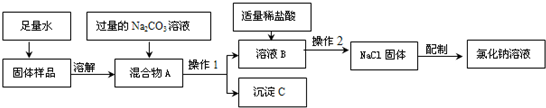
题目内容
下列氯化钠溶液,其溶质的质量分数不等于15%的是( )A.100g水中溶解15g氯化钠
B.氯化钠与水按15:85的质量比形成的溶液
C.100g溶液中含15g氯化钠
D.30g氯化钠溶解于170g水中所形成的溶液
【答案】分析:溶液中溶质的质量分数是指溶质的质量与溶液的质量之比.
解答:解:A、溶质的质量分数= ×100%═
×100%═ ×100%═13%;故符合题意
×100%═13%;故符合题意
B、溶质的质量分数= ×100%══
×100%══ ×100%═15%;故不符合题意
×100%═15%;故不符合题意
C、溶质的质量分数= ×100%══
×100%══ ×100%═15%;故不符合题意
×100%═15%;故不符合题意
D、溶质的质量分数= ×100%══
×100%══ ×100%═15%;故不符合题意
×100%═15%;故不符合题意
故选A
点评:本题难度不是很大,主要考查了溶质的质量分数的简单计算,从而培养学生的理解能力和计算能力.
解答:解:A、溶质的质量分数=
 ×100%═
×100%═ ×100%═13%;故符合题意
×100%═13%;故符合题意B、溶质的质量分数=
 ×100%══
×100%══ ×100%═15%;故不符合题意
×100%═15%;故不符合题意C、溶质的质量分数=
 ×100%══
×100%══ ×100%═15%;故不符合题意
×100%═15%;故不符合题意D、溶质的质量分数=
 ×100%══
×100%══ ×100%═15%;故不符合题意
×100%═15%;故不符合题意故选A
点评:本题难度不是很大,主要考查了溶质的质量分数的简单计算,从而培养学生的理解能力和计算能力.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
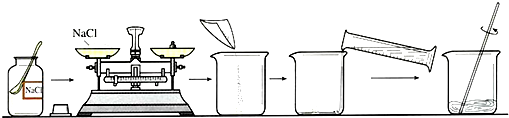
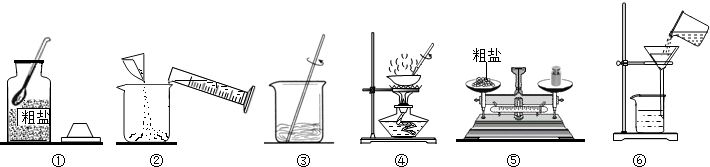
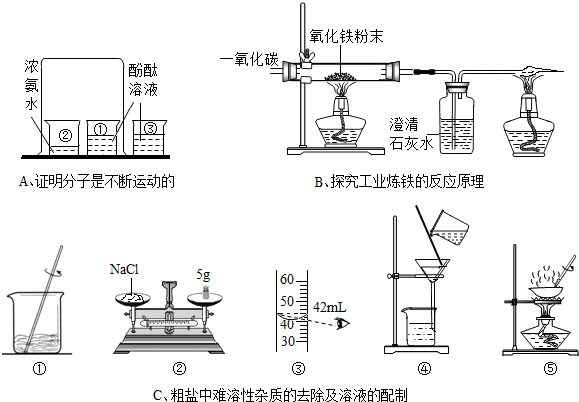
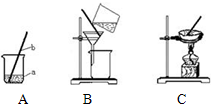 (1)在做粗盐初步提纯的实验时,要进行如图所示的实验操作.
(1)在做粗盐初步提纯的实验时,要进行如图所示的实验操作.