题目内容
【题目】某水泥厂新进一批石灰石原料,该厂检验室为了测定该石灰石中碳酸钙的质量分数,取该样品 12g 与足量稀盐酸在烧杯中恰好完全反应(假设石灰石样品中的杂质不与稀盐酸反应,而且也不溶于水),有关实验数据如表:(烧杯的质量为 82g)
反应前 | 反应后 | ||
实验数据 | 烧杯和稀盐酸的质量 | 石灰石样品的质量 | 烧杯和其中混合物的总质量 |
152.0g | 12.0g | 159.6g | |
(1)反应中生成二氧化碳的质量为_____;
(2)求该石灰石中碳酸钙的质量分数;(结果保留一位小数) _________
(3)反应后所得溶液的溶质的质量分数是多少?(结果保留一位小数) _________
【答案】4.4g 83.3% 14.7%
【解析】
(1)根据质量守恒定律可知:生成二氧化碳的质量=152.0g+12.0g-159.6g=4.4g;
(2)设碳酸钙的质量为x,反应后生成溶液的溶质的质量为y;
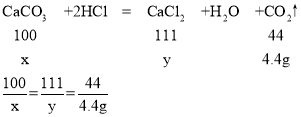
解得:x=10g,y=11.1g
该石灰石中碳酸钙的质量分数![]() ×100%=83.3%;
×100%=83.3%;
答:该石灰石中碳酸钙的质量分数83.3%;
(3)反应后生成溶液的溶质质量分数是:![]() ×100%=14.7%
×100%=14.7%
答:反应后生成溶液的溶质质量分数是14.7%。
答案:
(1)4.4g;
(2)83.3%;
(3)14.7%。

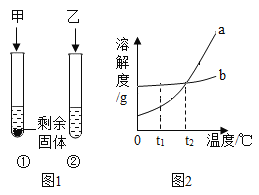
【题目】实验室中有一瓶标签受损的无色液体,如图所示,为探究其成分,化学小组进行了如下探究。
![]()
[提出问题] 这瓶无色液体是什么呢?
[交流讨论] 大家讨论后一致认为这瓶无色液体不可能是蒸馏水,理由是_______,认为也不可能是硝酸,理由是______。
[作出猜想] 猜想一:该液体可能是过氧化氢溶液;
猜想二:该液体可能是稀硫酸。
[实验探究] (1)取该液体适量于试管中,向其中加入少量______粉末,发现没有气泡产生,说明猜想一不正确。
(2)为证明猜想二成立,同学们设计了如下实验方案:
方案 | 实验操作 | 实验现象 |
① | 取该液体适量于试管中,向其中滴加________ | 溶液变红 |
② | 取该液体适量于试管中,向其中滴加少量氯化钡溶液 | _______ |
③ | 取该液体适量于试管中,向其中滴加_____溶液 | 产生大量气泡 |
[得出结论] 综合以上方案可知该液体是稀硫酸。
[反思交流] (1)为了防止标签受损,倾倒液体时标签应______。
(2)方案②中涉及的化学方程式为______。
【题目】金属在生产和生活中应用广泛。请回答下列问题。
(1)生活中常用铁锅做饭,主要利用了铁的_____性。
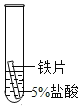
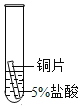
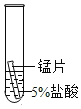
(2)某研究小组为探究铁、铜、锰(Mn)的金属活动性顺序,进行了如下三个实验(其中金属均已打 磨,且形状、大小相同,试管中所用 5%的盐酸体积相同)。
(实验记录与分析)
实验一 | 实验二 | 实验三 | |
实验操作 |
|
|
|
实验现象 | 立即产生气泡,速率较慢 | 无明显现象 | 立即产生气泡,速率较快 |
实验结论 | 铁、铜、锰的金属活动性顺序由强到弱为_____ | ||
写出实验一试管中发生反应的化学方程式_____。
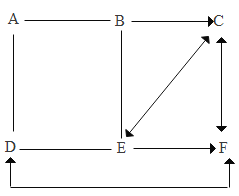
(3)小马同学根据上述结果,为了进一步证明三种金属的活动性,进行了如图所示的实验:
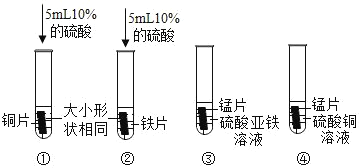
通过以上实验,也得出了与(2)相同的结论。小杨同学认为实验①~④中,不需要做的实验是_____(填 序号)。