题目内容
【题目】金属在生产和生活中应用广泛。请回答下列问题。
(1)生活中常用铁锅做饭,主要利用了铁的_____性。
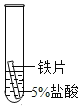
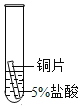
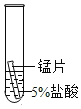
(2)某研究小组为探究铁、铜、锰(Mn)的金属活动性顺序,进行了如下三个实验(其中金属均已打 磨,且形状、大小相同,试管中所用 5%的盐酸体积相同)。
(实验记录与分析)
实验一 | 实验二 | 实验三 | |
实验操作 |
|
|
|
实验现象 | 立即产生气泡,速率较慢 | 无明显现象 | 立即产生气泡,速率较快 |
实验结论 | 铁、铜、锰的金属活动性顺序由强到弱为_____ | ||
写出实验一试管中发生反应的化学方程式_____。
(3)小马同学根据上述结果,为了进一步证明三种金属的活动性,进行了如图所示的实验:
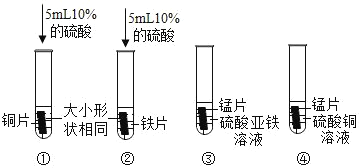
通过以上实验,也得出了与(2)相同的结论。小杨同学认为实验①~④中,不需要做的实验是_____(填 序号)。
【答案】导热 锰>铁>铜 Fe+2HCl=FeCl2+H2↑ ④
【解析】
(1)生活中常用铁锅做饭,主要利用了铁的导热性。故填:导热;
(2)根据实验现象,锰与盐酸反应的速率大于铁与盐酸反应的速率,故锰的活泼性大于铁,铜不与盐酸反应,故铜最不活泼,从而得出三种金属的活动性顺序从强到弱依次为:锰>铁>铜,故填:锰>铁>铜;
实验一中铁与盐酸反应生成氯化亚铁和氢气,反应的化学方程式为:Fe+2HCl=FeCl2+H2↑;故填:Fe+2HCl=FeCl2+H2↑;
(3)通过实验①②,可以得出铁的金属活动性比氢强,铜的金属活动性比氢弱;通过反应③,可以得出锰的金属活动性比铁强;三种金属的活动性由强到弱的顺序为Mn>Fe>Cu。前三个实验已经得出了三种金属的活动性顺序,故实验①~④中,不需要做的实验是④。故填:④。

【题目】某水泥厂新进一批石灰石原料,该厂检验室为了测定该石灰石中碳酸钙的质量分数,取该样品 12g 与足量稀盐酸在烧杯中恰好完全反应(假设石灰石样品中的杂质不与稀盐酸反应,而且也不溶于水),有关实验数据如表:(烧杯的质量为 82g)
反应前 | 反应后 | ||
实验数据 | 烧杯和稀盐酸的质量 | 石灰石样品的质量 | 烧杯和其中混合物的总质量 |
152.0g | 12.0g | 159.6g | |
(1)反应中生成二氧化碳的质量为_____;
(2)求该石灰石中碳酸钙的质量分数;(结果保留一位小数) _________
(3)反应后所得溶液的溶质的质量分数是多少?(结果保留一位小数) _________
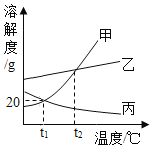
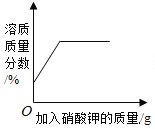
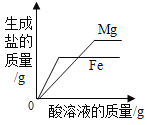
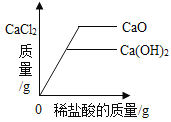
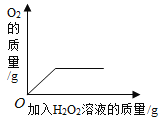
【题目】下列4个图像不能正确反映对应变化关系的是
|
|
|
|
A20°C时,向一定量的硝酸钾不饱和溶液中加人硝酸钾固体 | B向等质量的镁粉和铁粉中分别逐滴加入同浓度的稀盐酸至过量 | C等质量CaO和Ca(OH)2中分别加入等浓度 的稀盐酸至过量 | D向 盛有少量二氧化锰的烧杯中不断地加入 过氧化氢溶液 |
A.AB.BC.CD.D