题目内容
【题目】水是人类最宝贵的自然资源。回答下列问题
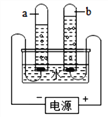
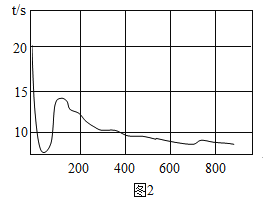
(1)上图实验装置中气体a是 _____气,气体a与气体b的体积比约为______ ;
(2) 水中加入少量氢氧化钠的目的是______________________;
(3) 电解水反应的化学方程式为 ______________ ;该实验的结论是_________。
(4) 生活中硬水软化常用的方法是__________ 。
【答案】 氢气 2:1 增强水的导电性 略 水是由氢、氧两种元素组成的 煮沸
【解析】(1)水电解时生成的氢气与氧气体积比是2:1,且正极产生氧气,负极产生的氢气可知:气体a与气体b的体积比为2:1;(3)水中加入少量氢氧化钠的目的是增强水的导电性;(3) 电解水反应的化学方程式为![]()
![]()
![]() ,由此可得出水是由氢元素和氧元素组成的结论;(4)生活中常采用加热煮沸的方法降低水的硬度。
,由此可得出水是由氢元素和氧元素组成的结论;(4)生活中常采用加热煮沸的方法降低水的硬度。

【题目】以下是老师引导学生探究“质量守恒定律”的教学片段,请你参与探究并帮忙填写空格(包括表中的空格)。
【提出问题】化学反应前后各物质的质量总和是否相等?
【猜想与假设】猜想1:不相等; 猜想2:相等。
【实验探究】甲、乙两组同学用托盘天平分别称量反应前后物质的质量。
甲组 | 乙组 | |
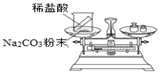
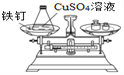
实验方案(反应后略) |
|
|
实验现象 | 有气泡产生,天平指针向右偏转 | 铁钉表面 ______,溶液____,天平指针_________偏转 |
结论 | 猜想1正确。有关反应的方程式是:Na2CO3+2HCl | 猜想2正确。反应的化学方程式:___________________ |
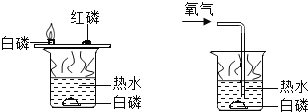
【反思评价】究竟哪种猜想正确?通过讨论,同学们发现甲组中有气体溢出,导致指针向右偏转。得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡是有气体生成或参加的反应一定要在____________中进行。
【优化装置】同学们对甲组左盘中的反应装置进行了如下三种改进,你认为最佳装置是___(填序号),从另外两种装置中任选一种指出其不足______(已知NaOH溶液能完全吸收CO2气体)
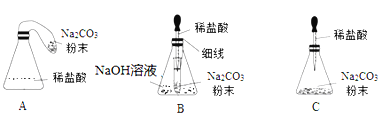
【得出结论】同学们利用改进后的最佳装置进行再次探究,均得出猜想二正确。进一步分析发现,反应体系中器材和未参加反应的物质的质量在反应前后保持不变,最终得出结论是:____的各物质的质量总和等于反应后生成的各物质的质量总和。
【解释应用】解释:化学反应前后,原子的种类、数目、质量均不变,所以质量守恒。
应用:某固体物质受热会发生分解反应,生成氧化铜、水和二氧化碳三种物质,则该固体物质一定由_________种元素组成。