题目内容
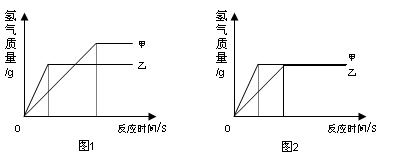
现有铁和另一种金属组成的混合物,在5.6g该混合物中加入100g一定溶质质量分数的稀盐酸,两者恰好完全反应,产生氢气的质量为m。下列说法正确的是
| A.若混合物为Fe、Al,m可能是0.2g |
| B.若混合物为Fe、Zn,m不可能是0.2g |
| C.若混合物为Fe、Zn,m可能是0.1g,则该混合物中铁的质量分数为50% |
| D.若混合物为Fe、A1,则稀盐酸中溶质质量分数一定大于7.3% |
BC
试题分析:相同质量的Al、Fe、Zn与足量的稀盐酸反应,产生的氢气的质量是Al>Fe>Zn。
设5.6g物质全部是铁,则产生氢气0.2g,若5.6g混合物为Fe、Al,m一定大于0.2g;
若5.6g混合物为Fe、Zn,m不可能是0.2g,一定小于0.2g;
若混合物为Fe、Zn,m一定小于0.2g,混合物种铁的质量分数为50%,则m一定大于0.1g,故C错误;
D、当粉末为Fe、Al合金时,因相同质量的铝消耗稀盐酸的质量比铁消耗盐酸的质量大,而5.6 g铁时,消耗盐酸的质量为7.3 g,所以合金为为Fe-Al合金时,所需盐酸溶质质量分数一定大于7.3%,故D正确;
AC错误,故选BD。
点评:相同质量的金属与酸反应产生氢气的质量的多少与金属的相对原子质量有关。同是+2价金属,若相对原子质量越大,产生的氢气质量越小。

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
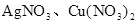 和
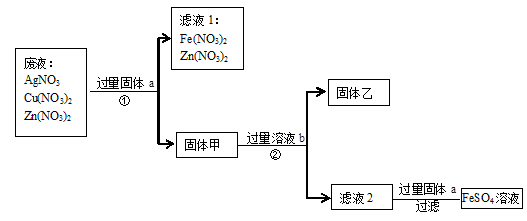
和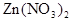 。为了减少废液对环境的污染,并回收银和铜,某化学小组同学设计了如下方案进行实验:
。为了减少废液对环境的污染,并回收银和铜,某化学小组同学设计了如下方案进行实验: