题目内容
(6分)金属材料在生活、生产中应用十分广泛。
(1)右图A是金属的一个应用实例,其利用金属的主要性质是____;右图B是两块金属片相互刻划后,在纯铜片上有明显的划痕。由此可得到的结论是____。

(2)写出工业上用一氧化碳与赤铁矿冶炼生铁的化学方程式_________________________。
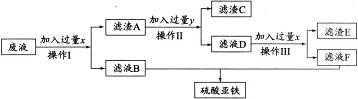
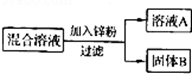
(3)某兴趣小组同学欲从含有硫酸、硫酸亚铁、硫酸铜的废液中回收全部的铜,并得到副产品硫酸亚铁,设计流程如图所示。
加入的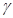 是____;写出上述有关反应的化学方程式______________。
是____;写出上述有关反应的化学方程式______________。
(1)右图A是金属的一个应用实例,其利用金属的主要性质是____;右图B是两块金属片相互刻划后,在纯铜片上有明显的划痕。由此可得到的结论是____。

(2)写出工业上用一氧化碳与赤铁矿冶炼生铁的化学方程式_________________________。
(3)某兴趣小组同学欲从含有硫酸、硫酸亚铁、硫酸铜的废液中回收全部的铜,并得到副产品硫酸亚铁,设计流程如图所示。

加入的
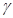 是____;写出上述有关反应的化学方程式______________。
是____;写出上述有关反应的化学方程式______________。(1)导热性 黄铜比纯铜的硬度大
(2)Fe2O3 + 3CO 2Fe + 3CO2
2Fe + 3CO2
(3)稀硫酸(或H2SO4)
Fe + H2SO4=FeSO4 + H2↑ Fe + CuSO4=FeSO4 + Cu (2分) 写对1个方程式给1分
(2)Fe2O3 + 3CO
 2Fe + 3CO2
2Fe + 3CO2(3)稀硫酸(或H2SO4)
Fe + H2SO4=FeSO4 + H2↑ Fe + CuSO4=FeSO4 + Cu (2分) 写对1个方程式给1分
试题分析:(1)金属锅是利用金属的导热性;图B两块金属片相互刻划后,在纯铜片上有明显的划痕,说明黄铜比纯铜的硬度大。
(2)工业上用一氧化碳与赤铁矿冶炼生铁的化学方程式为Fe2O3 + 3CO
 2Fe + 3CO2
2Fe + 3CO2(3)因为铁的活动性强于铜,强于氢,题中首先加入过量的铁粉,反应完成后过滤,滤渣中含有铜和剩余的铁粉,为了除去铁粉,得到铜,需要向滤渣中加入过量的稀硫酸,即加入的
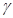 是稀硫酸;有关反应的化学方程式为Fe + H2SO4=FeSO4 + H2↑;Fe + CuSO4=FeSO4 + Cu
是稀硫酸;有关反应的化学方程式为Fe + H2SO4=FeSO4 + H2↑;Fe + CuSO4=FeSO4 + Cu 点评:金属活动性顺序:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au。在金属活动性顺序中,氢前的金属能与酸发生置换反应,且位置越靠前,反应越剧烈;位置在前的金属能把位于其后的金属从其盐溶液中置换出来。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 3FeCl2,Cu+2FeCl3
3FeCl2,Cu+2FeCl3