题目内容
【题目】某兴趣小组的同学从实验室收集到一桶含有FeSO4、CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体(FeSO4·7H2O),设计了如下实验方案,请回答下列问题:
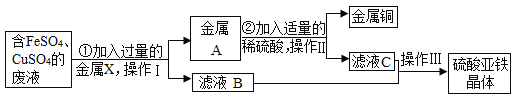
(1)操作Ⅰ、Ⅱ都为________;
(2)步骤①中,金属X是________,该反应的化学方程式为______;
(3)步骤②中,加稀硫酸的目的是_______。该反应的化学方程式为____;
(4)滤液B、C中的溶质是__________;
【答案】过滤 Fe Fe+CuSO4=FeSO4+Cu 除去过量的铁 Fe+H2SO4=FeSO4+H2↑ FeSO4
【解析】
(1)操作Ⅰ、Ⅱ都是将固体和液体分开,为过滤,
(2)由题意可知,由于需要将铜离子转化为铜单质,而溶液还必须为硫酸亚铁,即不能引入新的杂质,所以可以加入铁将铜离子转化为铜单质.该反应的化学方程式为:Fe+CuSO4=FeSO4+Cu;
(3)因为步骤①中,金属铁过量,故步骤②中,加入过量稀硫酸的目的是除去铜中的铁. 铁与硫酸反应生成硫酸亚铁和氢气,化学方程式为:Fe+H2SO4=FeSO4+H2↑;
(4)滤液B、C中的溶质是硫酸亚铁.
故答案为:
(1)过滤;(2)Fe;Fe+CuSO4=FeSO4+Cu;(3)除去过量的铁;Fe+H2SO4=FeSO4+H2↑;(4)FeSO4.

练习册系列答案
相关题目
【题目】下列各项指定数据前者小于后者的是
选项 | 数据 | ||
A | 溶液温度 | 室温下10gNH4NO3溶于100g水 | 室温下10gNaOH溶于100g水 |
B | 氧元素的质量分数 | 甲醛(HCHO) | 葡萄糖(C6H12O6) |
C | 二氧化碳的体积分数 | 人体呼出的气体 | 人体呼入的气体 |
D | 含碳量 | 生铁 | 钢 |
A.AB.BC.CD.D