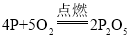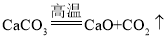题目内容
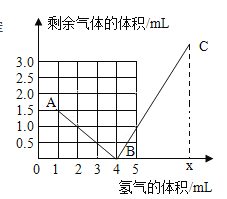
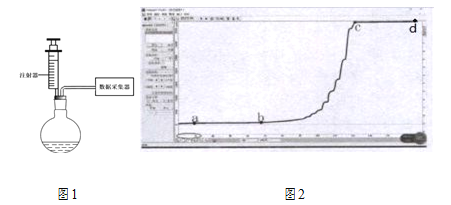
【题目】兴趣小组的同学为了研究(Cu﹣Zn合金)样品中铜的含量,取该样品20g跟足量的稀硫酸充分反应,产生氢气的质量与所用稀硫酸的质量关系如下图所示.请计算:
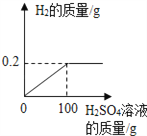
(1)反应的硫酸质量为多少g。
(2)求样品中铜的含量。
【答案】﹙1﹚9.8g;(2)67.5%
【解析】该样品20g跟足量的稀硫酸充分反应,产生氢气的质量为0.2g,
设20g该样品中锌的质量为x,参加反应硫酸的质量为y,
Zn+H2SO4=ZnSO4+H2↑
65 98 2
x y 0.2g
![]() ,
, ![]()
x=6.5g,y=9.8g
所以样品中铜的质量为:20g-6.5g=13.5g,样品中铜的含量![]() 100%=67.5%;
100%=67.5%;
答:(1) 反应的硫酸质量为:9.8g;(2) 样品中铜的含量为:67.5%。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
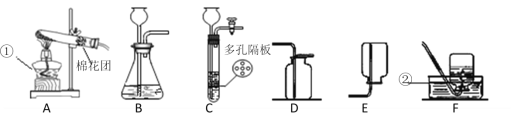
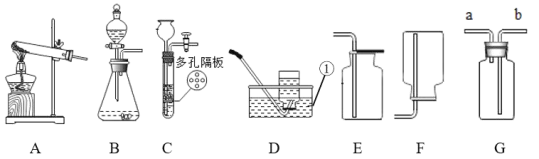
口算与应用题卡系列答案【题目】某研究性学习小组利用下图装置进行一氧化碳还原氧化铁的实验。
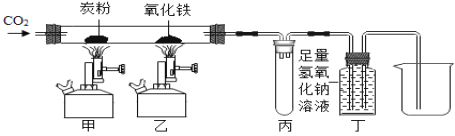
回答下列问题:
(1)实验开始时,首先应_____;实验中通入CO2的作用:①排出装置内的空气,②_____(用化学方程式表示)。
(2)写出一氧化碳还原氧化铁的化学反应方程式_____,该反应_____(选填“是”或“否”)置换反应。
(3)丁处试剂瓶中发生的主要反应的化学方程式_____。
(4)对该装置你认为下列说法正确的是_____(选填序号)。
A丙处试管可防止液体倒吸 B该装置的不足之处是未进行尾气处理
(5)当观察到_____(填实验现象),停止加热,待冷却后,用磁铁吸引硬质玻璃管中的黑色粉末,黑色粉末被吸起。小军同学说,该黑色粉末是铁。小明说,该黑色粉末不一定是铁。于是,他们对生成的黑色粉末进行探究。
查阅资料:①CO还原Fe2O3的产物与反应温度有关。
②Fe3O4为黑色粉末,能与盐酸反应,含有Fe3+的盐溶液遇到KSCN(硫氰化钾)溶液时变成红色,Fe(OH)2是一种白色沉淀,在空气中易被氧气氧化。
进行实验:
实验操作 | 现象 |
步骤一:取黑色粉末加入盐酸 | 溶解,无气泡,溶液呈浅黄绿色 |
步骤二:取步骤一所得溶液,滴加KSCN溶液 | 溶液变红 |
步骤二:再取步骤一所得溶液,加入足量的NaOH溶液 | 有红褐色沉淀生成,同时还有少量的白色沉淀生成,但最终白色沉淀都变成了红褐色沉淀 |
实验结论:①黑色粉末是_____(填名称)。
②写出黑色粉末与盐酸反应的化学方程式_____。