题目内容
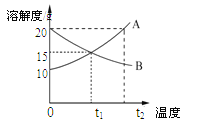
【题目】20℃时,将等质量的甲、乙两种固体物质,分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,甲、乙两种物质的溶解度曲线如图3。请结合
图示回答下列问题:
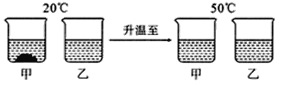
图1 图2
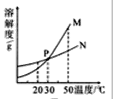
图3
(1)图1中一定为饱和溶液的是__________。
(2)图2中甲、乙两溶液中溶质质量分数的大小关系为_________________。
(3)图3中表示乙的溶解度曲线是_________;P点表示的含义是_____________。
(4)将50℃ 时甲、乙物质的饱和溶液降温至20℃,析出晶体甲的质量________乙的质量。(填“>”、“<”、或“无法确定”)
【答案】甲 相等 N 30℃时,甲、乙两种固体物质的溶解度相等 无法确定
【解析】
(1)甲中有未溶解的固体,所以甲一定为饱和溶液;
(2)图2中,由于甲乙均全部溶解,即为相同质量的溶剂溶解了相同质量的溶质,根据溶质质量分数的计算公式可知,其溶质质量分数相等;
(3)根据图1中信息可知,20℃时,甲的溶解度小于乙的溶解度,而图3中,20℃时,N曲线的溶解度大于M曲线的溶解度,故N表示的是乙物质的溶解度曲线;P点为30℃时,M、N曲线的交点,根据溶解度曲线的意义可知,P点表示30℃时,甲、乙两种固体物质的溶解度相等;
(4)将50℃时,等质量两种物质的饱和溶液降温至20℃,析出晶体的质量是甲比乙多,因为不知道溶液的质量,故无法比较析出晶体的质量大小。

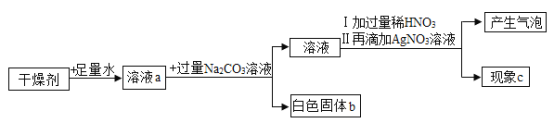
【题目】图一、图二是某兴趣小组探究金属、酸的化学性质时所做的两组实验。实验结束后,将两组实验试管中的物质分别全部倒入甲、乙两个洁净的烧杯中,据图回答:
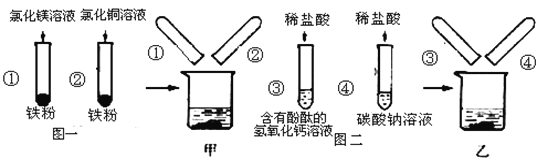
(1)在图一所示的实验中,试管②中发生反应的化学方程式是___________。
(2)将①②两只试管反应后的液体倒入甲烧杯中,发现红色固体物质明显增多。完全反应后,甲烧杯中的溶液中一定含有的阳离子是:_____________。
(3)当观察到③试管中的液体____________时,证明盐酸和氢氧化钙溶液能发生反应。
(4)将③④两只试管反应后的液体倒入乙烧杯中,观察到先有气泡产生,后有白色沉淀出现,溶液呈无色。则试管④反应后的溶液中的溶质共有哪些___________________(写化学式)。
(5)将乙烧杯内的物质进行过滤,对所得无色滤液中溶质成分进行了如下探究:
甲同学认为无色滤液中一定含有NaCl和 HCl,你认为甲同学的观点是否正确_________,其原因是:_________。
乙同学认为无色滤液中一定含有NaCl,一定不含有Na2CO3;
丙同学认为无色滤液中一定含有NaCl,还可能含有另外一种物质,于是做了如下实验:
实验操作 | 实验现象 | 实验结论 |
步骤1:取少量滤液于试管中,向其中滴加足量的__________溶液 | 有白色沉淀生成 | 滤液中的溶质有NaCl 和________ (写化学式) |