��Ŀ����
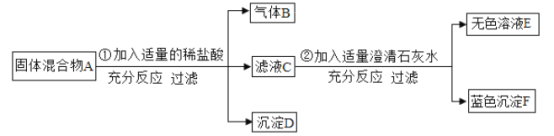
����Ŀ��ij���������CaO��NaOH��CaCl2�е��������ʣ�Ϊ̽����ɷ֣��������ͼ��ʾ��ʵ�顣�Իش�
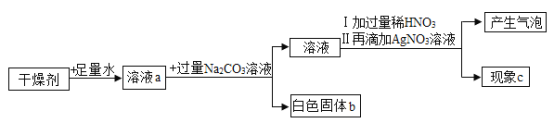
(1)д�����ɰ�ɫ����b�Ļ�ѧ����ʽ___(��дһ��)��
(2)�������м������ϡ�����Ŀ����__����������ϡ�������ϡ��������ĺ����__
(3)������C�ް�ɫ�������ɣ��������ijɷ�Ϊ___
(4)������C�а�ɫ�������ɣ������������Ϊ2.87g��ͬʱ��ð�ɫ����b������Ϊ1g��������C��ɫ�����Ļ�ѧʽΪ___�������ijɷ�Ϊ___
���𰸡�Ca(OH)2+Na2CO3��CaCO3��+2NaOH(��CaCl2+Na2CO3��CaCO3��+2NaCl) ��ȫ��ȥNaOH��Na2CO3��������ż��������� ���������ӣ�����Һa�������ӵļ�����ɸ��� CaO��NaOH CaCO3 NaOH��CaCl2
��������
(1)�����������ƺ�̼���Ʒ�Ӧ����̼��Ƴ������������ƣ��Ȼ��ƺ�̼���Ʒ�Ӧ����̼��Ƴ������Ȼ��ƣ���ѧ����ʽΪ��Ca(OH)2+Na2CO3��CaCO3��+2NaOH(��CaCl2+Na2CO3��CaCO3��+2NaCl)��
(2)���������ӣ���������֮ǰ����Ҫ���ų�̼������Ӻ����������ӵĸ��ţ����Լ��������ϡHNO3��Ŀ���ǣ���ȫ��ȥNaOH��Na2CO3��������ż��������ӣ��������ϡHNO3��Һ������ϡHCl��Һ�������������������ӣ��������ӵļ�����ɸ��ţ�
(3)����c���ް�ɫ��������ɫ�����в��������ӣ����Ը�����ɷ�ΪCaO��NaOH��
(4)��ɫ����b��̼��ƣ���ѧʽΪCaCO3��
���������غ㶨�ɼ����Ȼ��Ƶ�����Ϊ��
2.87g��![]() ��
��![]() ��1.11g
��1.11g
�Ȼ����к��и�Ԫ������Ϊ��
1.11g��![]() ��0.4g
��0.4g
1g̼����к��и�Ԫ�ص�����Ϊ��
1g��![]() ��0.4g
��0.4g
�ʸ�����в���CaO����ɷ�ΪNaOH��CaCl2��

 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�����Ŀ������������ֳ�����ʳƷ���Ӽ���������Ϣ�ش�����
���� | �������� | ��˹���� | �������ܲ��� | ���ߺ��� |
��ѧʽ | NaNO2 | C14H18O5N2 | C40H56 | (C6H10O5)7 |
��� | ��������ɫ�� | ��ζ�� | ��ɫ��Ӫ��ǿ���� | ������ |
���ʹ����(ÿ1kg) | ����0.15g | ����0.5g | ������0.02g | �����ǹ�20.0g |
(1)�����������������������___��
(2)��˹����___(����ڡ������ڡ�)���ࡣ
(3)�����˰���˹���ij�����У�����⺬��Ԫ�ص���������Ϊ0.028%(������˹���������ʲ�����Ԫ��)����������а���˹�����������Ϊ�Ƿ��������___(��ǡ���)��
(4)���ҹ�Ӧ�ý�ֹʹ�����е�ʳƷ���Ӽ���������˵���Ƿ���ȷ��˵�����ɣ�___(дһ������)