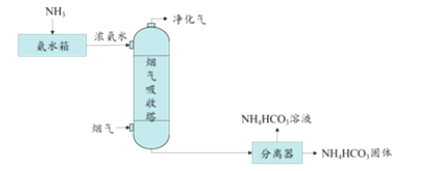
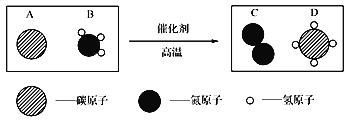
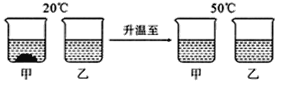
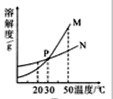
��Ŀ����
����Ŀ��ͼһ��ͼ����ij��ȤС��̽����������Ļ�ѧ����ʱ����������ʵ�顣ʵ�����������ʵ���Թ��е����ʷֱ�ȫ������ס��������ྻ���ձ��У���ͼ�ش�
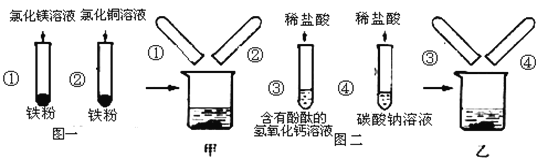
��1����ͼһ��ʾ��ʵ���У��Թܢ��з�����Ӧ�Ļ�ѧ����ʽ��___________��
��2�����٢���ֻ�Թܷ�Ӧ���Һ�嵹����ձ��У����ֺ�ɫ���������������ࡣ��ȫ��Ӧ���ձ��е���Һ��һ�����е��������ǣ�_____________��
��3�����۲쵽���Թ��е�Һ��____________ʱ��֤�����������������Һ�ܷ�����Ӧ��
��4�����ۢ���ֻ�Թܷ�Ӧ���Һ�嵹�����ձ��У��۲쵽�������ݲ��������а�ɫ�������֣���Һ����ɫ�����Թܢܷ�Ӧ�����Һ�е����ʹ�����Щ___________________��д��ѧʽ����
��5�������ձ��ڵ����ʽ��й��ˣ���������ɫ��Һ�����ʳɷֽ���������̽����
��ͬѧ��Ϊ��ɫ��Һ��һ������NaCl�� HCl������Ϊ��ͬѧ�Ĺ۵��Ƿ���ȷ_________����ԭ���ǣ�_________��
��ͬѧ��Ϊ��ɫ��Һ��һ������NaCl��һ��������Na2CO3��
��ͬѧ��Ϊ��ɫ��Һ��һ������NaCl�������ܺ�������һ�����ʣ�������������ʵ�飺
ʵ����� | ʵ������ | ʵ����� |
����1��ȡ������Һ���Թ��У������еμ�������__________��Һ | �а�ɫ�������� | ��Һ�е�������NaCl ��________����д��ѧʽ�� |
���𰸡�Fe+CuCl2=Cu+FeCl2 Mg2+��Fe2+ ��Һ�ɺ�ɫ�����ɫ Na2CO3��NaCl ����ȷ CaCO3�����ᷴӦ���������ɣ� Na2CO3 CaCl2
��������
��1���Թܢ��з����ķ�Ӧ�������Ȼ�ͭ��Ӧ�����Ȼ�������ͭ���ʷ�Ӧ�Ļ�ѧ����ʽдΪ��Fe+CuCl2=FeCl2+Cu��
��2����ɫ�����������������ԭ�����Թܢ��е�δ��Ӧ���������Թܢ���ʣ����Ȼ�ͭ��Ӧ�������Ȼ�������ͭ��������ȫ��Ӧ���ձ��е���Һ��һ�������Ȼ�������δ�μӷ�Ӧ���Ȼ�þ�����ձ��е���Һ��һ�����е����������Ȼ�þ�������þ���Ӻͷ�Ӧ���ɵ��Ȼ�������������������ӣ������ӷ��ŷֱ�ΪMg2+��Fe2+������Mg2+��Fe2+��
��3����̪��Һ����������Һ��죬�������Ի�������Һ����ɫ����Ϊ��ɫ������������Һ�ʼ��ԣ��μӷ�̪��Һ����Һ��죬����Һ�м���ϡ���ᣬ�������������Ʒ����кͷ�Ӧ�����۲쵽��Һ�ɺ�ɫ�����ɫʱ��˵����Һ�����Լ��ԣ�����֤�����������������Һ�ܷ�����Ӧ��������Һ�ɺ�ɫ�����ɫ��
��4�����ۢ���ֻ�Թܷ�Ӧ���Һ�嵹�����ձ��У�������������Ϊ�Թܢ���ʣ���̼�������Թܢ��е�ϡ���ᷴӦ�������Ȼ��ơ�ˮ�Ͷ�����̼����ɫ�������֣�����Ϊ�Թܢ��з�Ӧ���ɵ��Ȼ������Թܢ���ʣ���̼���Ʒ�Ӧ�������Ȼ��ƺ�̼��Ƴ���������˵�����ǰ�Թܢ��е�������������̼���Ʒ�Ӧ���ɵ��Ȼ��ƺ�ʣ���̼���ƣ��仯ѧʽ�ֱ���NaCl�� Na2CO3������Na2CO3�� NaCl��
��5����ͬѧ��Ϊ��ɫ��Һ��һ������NaCl�� HCl�����ֹ۵��Dz���ȷ�ģ������ȷ��
�ۢ���ֻ�Թܷ�Ӧ���Һ�嵹�����ձ��У��������ݲ������Թܢ���ʣ���̼�������Թܢ��е�ϡ���ᷴӦ�������Ȼ��ơ�ˮ�Ͷ�����̼�����а�ɫ������������Ϊ�Թܢ��з�Ӧ���ɵ��Ȼ������Թܢ���ʣ���̼���Ʒ�Ӧ�������Ȼ��ƺ�̼��Ƴ�����˵��������̼���Ʒ�Ӧ���������ʣ�࣬����Na2CO3�����ᷴӦ���������ɣ���
�����Ϸ�����֪�����ձ��е������мȲ������ᣬҲ����̼���ƣ������ձ���һ������̼�����������Լ����Ȼ��Ʒ�Ӧ���ɵ��Ȼ��ƺͿ���ʣ����Ȼ��ơ��Ȼ�������̼���Ʒ�Ӧ����̼��Ƴ�����Ϊ�����Ȼ����Ƿ���ڣ�������ɫ��Һ�м���̼������Һ���۲��Ƿ��������������Na2CO3��
����̼������Һ�������ɫ������˵����Һ�л����Ȼ��ƴ��ڣ��仯ѧʽΪCaCl2������CaCl2��

����Ŀ������������ֳ�����ʳƷ���Ӽ���������Ϣ�ش�����
���� | �������� | ��˹���� | �������ܲ��� | ���ߺ��� |
��ѧʽ | NaNO2 | C14H18O5N2 | C40H56 | (C6H10O5)7 |
��� | ��������ɫ�� | ��ζ�� | ��ɫ��Ӫ��ǿ���� | ������ |
���ʹ����(ÿ1kg) | ����0.15g | ����0.5g | ������0.02g | �����ǹ�20.0g |
(1)�����������������������___��
(2)��˹����___(����ڡ������ڡ�)���ࡣ
(3)�����˰���˹���ij�����У�����⺬��Ԫ�ص���������Ϊ0.028%(������˹���������ʲ�����Ԫ��)����������а���˹�����������Ϊ�Ƿ��������___(��ǡ���)��
(4)���ҹ�Ӧ�ý�ֹʹ�����е�ʳƷ���Ӽ���������˵���Ƿ���ȷ��˵�����ɣ�___(дһ������)